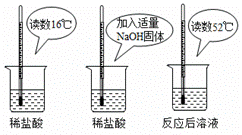
日常生活中常用氢氧化钠溶液来清洗炉具、油烟机等,李华在周末帮助家人清洗油烟机,他用自来水配制氢氧化钠溶液时总是出现浑浊,静置一会儿溶液底部还会出现较多的白色沉淀物。
(提出问题)配制氢氧化钠溶液时为什么会出现浑浊?
(作出猜想)李华根据课本知识对出现的异常现象作出如下猜想:
猜想Ⅰ:所用氢氧化钠不纯,其中含有不溶性杂质。
猜想Ⅱ:氢氧化钠能与自来水中的某种物质反应,生成了难溶性物质。
(查阅资料)①徐州地区石灰岩分布广泛,导致水中含有较多的碳酸氢钙(Ca(HCO3)2)。
②在溶液中,碳酸氢钙能与氢氧化钠反应生成碳酸钙。
③碳酸氢钙受热易分解,生成碳酸钙、二氧化碳和水。
(实验验证)
| 实验步骤 | 实验现象 | 实验结论 |
| ①取氢氧化钠样品少许,加入足量的_______,并搅拌 | 没有出现浑浊 | 猜想I错误 |
| ②取少许配制氢氧化钠溶液时产生的白色沉淀物,加入足量的稀盐酸 | __________ | 白色沉淀物是_________,猜想Ⅱ正确 |
(拓展延伸)
(1)李华在家里将该自来水经过________后可用于配制氢氧化钠溶液,其原理是_____________(用化学方程式表示)。
(2)李华设计如图W形玻璃管进行步骤②探究稀盐酸的浓度对反应速率的影响(反应时只要将W形玻璃管竖起即可将药品混合),通过对比________可判断反应的快慢,该装置的优点是________。
(实验验证)蒸馏水 固体溶解,有气泡产生 碳酸钙(或CaCO3)
(拓展延伸)(1)煮沸 ![]()
(2) 气球鼓起的速度 装置简单,便于添加药品,实验现象明显
【解析】实验验证:①如果将氢氧化钠样品加入足量的蒸馏水中,充分搅拌后全部溶解,则说明该氢氧化钠样品中没有不溶性杂质,即猜想I错误。②根据实验结论“猜想Ⅱ正确”可知,该白色沉淀物是水中的碳酸氢钙与氢氧化钠反应生成碳酸钙,因此加入稀盐酸后的实验现象是固体溶解,有气泡产生。拓展延伸:(1)该地自来水中含有碳酸氢钙,碳酸氢钙受热易分解,因此经过煮沸后,水的硬度降低,用此水配制氢氧化钠溶液就不会出现不溶物。煮沸时,碳酸氢钙分解生成碳酸钙、水和二氧化碳,有关的化学方程式是![]() 。(2)通过对比气球鼓起的速度可判断反应的快慢,该装置的优点是装置简单,便于添加药品,实验现象明显。
。(2)通过对比气球鼓起的速度可判断反应的快慢,该装置的优点是装置简单,便于添加药品,实验现象明显。
某化学兴趣小组将光亮铜片放在酒精灯火焰上灼烧,发现表面变黑,他们对黑色物质的成分产生了兴趣,铜片表面的黑色物质是什么呢?

(查阅资料)
(1)酒精不充分燃烧产生炭黑(即黑烟);
(2)氧气的化学性质比较活泼,加热条件下能与金属铜反应生成黑色的氧化铜。
(3)氧化铜能与稀硫酸反应生成硫酸铜和水;炭黑难溶于水,且与稀硫酸不发生反应。
(猜想与假设)
猜想1:黑色物质是炭黑。
猜想2:黑色物质是空气中的氧气与铜反应生成的氧化铜。
猜想3:黑色物质既有炭黑又有氧化铜。
(进行实验)
| 实验步骤 | 实验现象 |
| 实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热 | 铜片变黑 |
| 实验二:取一支试管,将一小段光亮铜片放入试管中,塞上胶塞,并用注射器抽出试管内的空气,封好胶塞,并加热,趁热取下胶塞,观察现象 | 打开胶塞前铜片不变黑;打开胶塞后铜片变黑 |
| 实验三:将在酒精灯火焰上灼烧后的附着黑色物质的铜片,投入到盛有足量稀硫酸的试管中 | 试管中没有黑色物质剩余,溶液由无色变为蓝色 |
(解释与结论)
(1)由实验可知,猜想________成立。
(2)实验二用注射器抽出试管内空气的目的是_________。
(3)通过对黑色物质来源的探究,金属铜与氧气反应的化学方程式是_________
(4)通过实验一和实验三都能得出猜想1和猜想3不正确,两个实验是从两个角度进行设计实验方案的,实验一是从____________的角度探究;实验三是从_____________的角度探究。
(反思拓展)
(5)实验一为什么能将猜想1和猜想3同时排除呢?你认为依据是_____________________。
(1)2
(2)探究黑色固体的生成是否与氧气有关(或使铜片不与氧气接触)
(3)![]()
(4) 反应物 生成物 验证生成物
(5) 在试管中加热,铜片不直接接触酒精灯的火焰
【解析】(1)实验一中将光亮的铜片,放入试管内加热,观察到铜片变黑,说明黑色固体不是炭黑;实验二中取一支试管,将一小段光亮的铜片放入试管中,塞上胶塞并抽出试管中的空气,加热,观察到铜片不变色,趁热打开胶塞后,铜片变黑,说明铜片变黑与空气中的氧气有关;实验三中,将表面变黑的铜片放入稀硫酸中,观察到黑色固体全部溶解,且溶液变为蓝色,证明黑色固体是CuO,即可得出猜想2成立;(2)真空没有氧气可使铜片不与氧气接触,所以会出现打开胶塞前(真空、无氧气)铜片不变黑,打开胶塞后,热铜片与空气中的氧气接触,铜片变黑,因此,实验二用注射器抽出试管内空气的目的是使铜片不与氧气接触;(3)金属铜与氧气在加热的条件下反应生成氧化铜,反应的化学方程式是![]() ;(4)实验一用试管使铜片不与酒精灯直接接触,排除了酒精不完全燃烧的干扰,所以实验一是从参与反应的物质即反应物的角度探究;实验三是将灼烧后附着黑色固体的铜片放入稀硫酸中,所以验证的是生成物; (5)将铜片放在试管中再加热,铜片没有直接接触酒精灯的火焰,也就不会有炭黑生成;
;(4)实验一用试管使铜片不与酒精灯直接接触,排除了酒精不完全燃烧的干扰,所以实验一是从参与反应的物质即反应物的角度探究;实验三是将灼烧后附着黑色固体的铜片放入稀硫酸中,所以验证的是生成物; (5)将铜片放在试管中再加热,铜片没有直接接触酒精灯的火焰,也就不会有炭黑生成;
某探究兴趣小组在学习碳单质的化学性质时发现,碳单质不能与稀硫酸发生反应,但碳粉与浓硫酸在加热条件下反应有气体生成,小组同学为了了解该气体的成分,于是进行了进一步的探究。
(提出问题)碳粉与浓硫酸反应生成的气体是什么?
(查阅资料)二氧化硫能与高锰酸钾溶液反应,使高锰酸钾溶液褪色;二氧化硫还能使澄清石灰水变浑浊。
(猜想与假设)
猜想1:该气体是SO2
猜想2:该气体是CO2
猜想3:该气体是NH3
猜想4:该气体是SO2和CO2
上述猜想_____________________不成立,原因是________________________________。
(实验探究)
| 实验操作 | 实验现象 | 实 验结论 |
| ① 将气体通入适量高锰酸钾溶液中 | 溶液由紫红色逐渐变为无色 | 猜想___________不成立 |
| ② 将①中通过高锰酸钾溶液的气体通入澄清石灰水中 | _________________。 | 猜想4成立 |
(反思与评价)某同学认为该气体中可能含有CO,于是设计如下方案,请你帮他补充方案及现象:先将气体通过足量的碱石灰,然后_______________________________,经过实验后,该同学得知该气体中不含CO。
(拓展延伸)
(1)二氧化硫能使高锰酸钾溶液褪色,二者反应的化学方程式为![]() ,其中X的化学式为_______________________________。
,其中X的化学式为_______________________________。
(2)二氧化硫的性质与二氧化碳相似,但二氧化硫会污染空气,故实验过程中需要进行尾气处理,请写出一个尾气处理的方法_______________________________。
(猜想与假设)3 化学反应前后元素种类不变,反应物中不含氮元素
(实验探究)2 澄清石灰水变浑浊
(反思与评价)点燃气体,观察到气体未被点燃
(拓展延伸)H2O 将尾气通入氢氧化钠浓溶液中(合理即可)
【解析】(猜想与假设)根据质量守恒定律知,化学反应前后元素种类不变,由反应物碳和浓硫酸中所含元素种类分析,猜想该气体是二氧化硫或二氧化碳或两种气体的混合物,由于反应物中不含氮元素,因此该气体一定不含氨气,故猜想3错误。(实验探究)①根据(查阅资料)内容以及实验现象分析,可知该气体中含有二氧化硫,因此猜想2不成立。②通过实验操作①已将二氧化硫除去,结合实验结论“猜想4成立" ,可知气体中含有二氧化碳,将二氧化碳通入澄清石灰水中,现象为澄清石灰水变浑浊。( 反思与评价)根据CO具有可燃性,可先将混合气体通过碱石灰,二氧化硫、二氧化碳和水均可被碱石灰吸收,然后将气体点燃,根据所观察到的实验现象可判断该气体中是否含有CO,点燃气体,观察到气体未被点燃,说明没有一氧化碳。(拓展延伸)(1)根据质量守恒定律:反应前后①元素种类不变、②原子数目不变,可得出X的化学式为H2O。(2)二氧化硫为酸性气体,能与碱溶液反应,因此可将尾气通入氢氧化钠浓溶液中,除去二氧化硫。
在研究酸碱中和反应时,某小组同学想证明:稀硫酸或稀盐酸与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了中和反应。请与他们一起完成实验方案的设计实施和评价。
(1)实验一:用数字化传感器测得稀硫酸与NaOH溶液混合前后的pH变化(20℃)图像
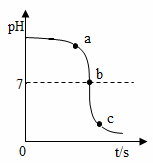
该实验的试剂滴加方法是______________;证明酸和碱发生了中和反应的依据是_______________。
结论:稀硫酸与NaOH溶液发生了中和反应,并且___________过量。
反思:上述方案的设计思想是_________________;要确认稀硫酸与NaOH溶液发生的反应是中和反应,还需要增补的实验步骤是_________________。
(2)实验二:为了获取稀盐酸与NaOH溶液也能发生中和反应的证据,实施了以下方案:
| 学生探究 | 实验过程 | 实验现象 | 结论 |
| 方案① |
| 加入氢氧化钠固体后,温度计示数明显上升 | 稀盐酸与氢氧化钠溶液发生了放出热量的中和反应 |
| 方案② |
| 加入氢氧化钠溶液后,温度计示数上升;混合后溶液的 | 稀盐酸与氢氧化钠溶液发生了生成盐和水并放出热量的中和反应 |
| 方案③ |
| 出现白色沉淀 | 稀盐酸与氢氧化钠发生了生成盐和水的中和反应 |
请你评价上述三组由实验现象获得的结论是否正确,并说明理由。
方案①:____________________。
方案②:___________________。
方案③:_______________。
(3)拓展:为探究影响中和反应放出热量多少的因素,又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入溶质质量分数为5%、10%、15%、20%、25%的盐酸36.5g,再向上述五只烧杯中分别加入40g 20%的NaOH溶液,最后测量其温度,数据记录如下表所示。
| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度/℃ | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
实验结论:影响中和反应放出热量多少的因素是__________。
(4)应用:简述中和反应在生活或生产中的一项应用___________。
(1)将稀硫酸逐滴滴入盛有一定量NaOH溶液的烧杯中 由a点到b点的溶液pH变小,b点时Ph=7 稀硫酸(或硫酸、酸) 将反应过程中溶液酸碱性的变化显性化(合理均可) 取反应后的溶液放入蒸发皿中加热,直至水分蒸发、有自色固体析出,并检验析出的白色固体是硫酸钠(合理均可)
(2)不正确,因为固体NaOH溶于水会放热,所以温度也会升高 正确,中和反应是酸和碱相互交换成分而生成盐和水的放热反应 不正确,稀盐酸和氯化钠与硝酸银反应都产生白色沉淀,不能说明稀盐酸和氢氧化钠溶液发生了化学反应(合理均可)
(3) 参加反应的酸与碱的溶质的质量(合理均可)
(4)用氢氧化镁中和过多的胃酸/用熟石灰中和土壤的酸性(合理均可)
【解析】(1)根据图像可知,反应前溶液的pH大于7,反应过程中溶液的pH逐渐变小,直至小于7,氢氧化钠溶液呈碱性,硫酸呈酸性,所以该实验的试剂滴加方法是将稀硫酸逐滴滴入盛有一定量溶液的烧杯中;证明酸和碱发生了中和反应的依据是由a点到b点的溶液pH变小,b点时Ph=7;稀硫酸与NaOH溶液发生了中和反应,并且硫酸过量;反思:上述方案的设计思想是将反应过程中溶液酸碱性的变化显性化(合理均可);中和反应是酸和碱相互交换成分而生成盐和水的反应,要确认稀硫酸与NaOH溶液发生的反应是中和反应,还需要增补的实验步骤是取反应后的溶液放入蒸发皿中加热,直至水分蒸发、有自色固体析出,并检验析出的白色固体是硫酸钠(合理均可);(2)方案①:不正确,因为固体NaOH溶于水会放热,所以温度也会升高;方案②:正确,中和反应是酸和碱相互交换成分而生成盐和水的放热反应;方案③:不正确,稀盐酸和氯化钠与硝酸银反应都产生白色沉淀,不能说明稀盐酸和氢氧化钠溶液发生了化学反应(合理均可);(3)根据表中数据可知,A、B、C、D、E的五只烧杯中装入的盐酸中的溶质质量不同,影响中和反应放出热量多少的因素是参加反应的酸与碱的溶质的质量(合理均可);(4)中和反应在生活或生产中的一项应用是用氢氧化镁中和过多的胃酸/用熟石灰中和土壤的酸性(合理均可)。
在研究“酸碱中和反应”时,某兴趣小组同学想证明稀盐酸与氢氧化钠溶液混合后是否发生了化学反应,进行了如下探究:
(1)在盛有氢氧化的溶液的烧杯中入几滴酚酞溶液,再逐滴加入稀盐酸,并不断搅拌(如图一)。用数字化传感器测得盐酸与氢氧化钠溶液混合前后的温度变化情况(如图二)。
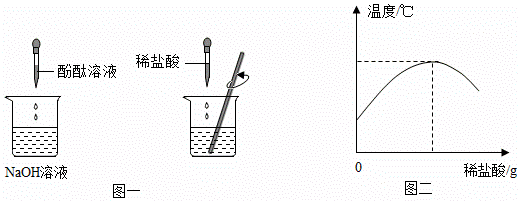
由实验现象和曲线变化情况分析可知,盐酸和氢氧化钠溶液发生了反应并_____(填“吸收”或“放出”)热量。
(2)从微观角度分析盐酸与氢氧化钠溶液的反应
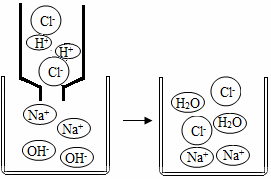
由如图可知,该反应的微观实质是_____。
(交流讨论)同学们讨论后认为,如果盐酸和氢氧化钠减少(或消失),或者有新物质生成,都能证明反应已经发生。
(3)探究实验后烧杯中溶质的成分。
| 步骤 | 现象 | 结论 |
| 实验1:取烧杯中的溶液少许于试管中,加入硫酸铜溶液 | _____ | 证明没有NaOH |
| 实验2;另取烧杆中的溶液少许于试管中,加入硝酸银溶液 | 出现白色沉淀 | 证明含有HCl |
| 实验3:再取烧杯中的溶液少许于蒸发皿中,加热蒸干 | 有_____产生 | 证明有NaCl生成 |
(得出结论)氢氧化钠溶液和盐酸发生了中和反应。
(评价反思)
Ⅰ.有同学认为,仅通过实验2得出“溶液中含有HCl”证据不足,理由是_____。
Ⅱ.运用中和反应,可以解决生产,生活中的实际同题。如工厂用氨水(NH3•H2O)处理废水中的硫酸,能得到一种氮肥一硫酸铵,写出该反应的化学方程式_____。
Ⅲ.多角度认识少学反应是学习化学的重变方法。
(1)放出
(2)氢离子和氢氧根离子结合生成水分子
(3)不产生蓝色沉淀 白色固体
Ⅰ.氯化钠也能和硝酸银反应生成白色沉淀氯化银
Ⅱ.2NH3•H2O+H2SO4=(NH4)2SO4+2H2O
【解析】(1)由实验现象和曲线变化情况分析可知,盐酸和氢氧化钠溶液发生了反应并放出热量。(2)由如图可知,该反应的微观实质是氢离子和氢氧根离子结合生成水分子。(3)取烧杯中的溶液少许于试管中,加入硫酸铜溶液,不产生蓝色沉淀,说明溶液中不含有氢氧化钠;再取烧杯中的溶液少许于蒸发皿中,加热蒸干,有白色固体产生,说明生成了氯化钠,实验过程如下所示:
| 步骤 | 现象 | 结论 |
| 实验1:取烧杯中的溶液少许于试管中,加入硫酸铜溶液 | 不产生蓝色沉淀 | 证明没有NaOH |
| 实验2;另取烧杆中的溶液少许于试管中,加入硝酸银溶液 | 出现白色沉淀 | 证明含有HCl |
| 实验3:再取烧杯中的溶液少许于蒸发皿中,加热蒸干 | 有白色固体产生 | 证明有NaCl生成 |
(评价反思)Ⅰ.有同学认为,仅通过实验2得出“溶液中含有HCl”证据不足,理由是氯化钠也能和硝酸银反应生成白色沉淀氯化银。故填:氯化钠也能和硝酸银反应生成白色沉淀氯化银Ⅱ.氨水和稀硫酸反应生成硫酸铵和水,该反应的化学方程式:2NH3•H2O+H2SO4=(NH4)2SO4+2H2O。
本卷还有25题,登录并加入会员即可免费使用哦~

该作品由: 用户bhgf分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。