在研究酸碱中和反应时,某小组同学想证明:稀硫酸或稀盐酸与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了中和反应。请与他们一起完成实验方案的设计实施和评价。
(1)实验一:用数字化传感器测得稀硫酸与NaOH溶液混合前后的pH变化(20℃)图像
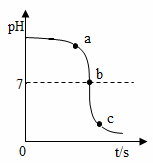
该实验的试剂滴加方法是______________;证明酸和碱发生了中和反应的依据是_______________。
结论:稀硫酸与NaOH溶液发生了中和反应,并且___________过量。
反思:上述方案的设计思想是_________________;要确认稀硫酸与NaOH溶液发生的反应是中和反应,还需要增补的实验步骤是_________________。
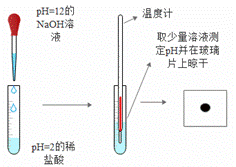
(2)实验二:为了获取稀盐酸与NaOH溶液也能发生中和反应的证据,实施了以下方案:
| 学生探究 | 实验过程 | 实验现象 | 结论 |
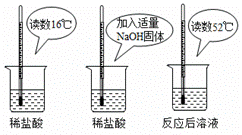
| 方案① |
| 加入氢氧化钠固体后,温度计示数明显上升 | 稀盐酸与氢氧化钠溶液发生了放出热量的中和反应 |
| 方案② |
| 加入氢氧化钠溶液后,温度计示数上升;混合后溶液的 | 稀盐酸与氢氧化钠溶液发生了生成盐和水并放出热量的中和反应 |
| 方案③ |
| 出现白色沉淀 | 稀盐酸与氢氧化钠发生了生成盐和水的中和反应 |
请你评价上述三组由实验现象获得的结论是否正确,并说明理由。
方案①:____________________。
方案②:___________________。
方案③:_______________。
(3)拓展:为探究影响中和反应放出热量多少的因素,又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入溶质质量分数为5%、10%、15%、20%、25%的盐酸36.5g,再向上述五只烧杯中分别加入40g 20%的NaOH溶液,最后测量其温度,数据记录如下表所示。
| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度/℃ | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
实验结论:影响中和反应放出热量多少的因素是__________。
(4)应用:简述中和反应在生活或生产中的一项应用___________。
答案
(1)将稀硫酸逐滴滴入盛有一定量NaOH溶液的烧杯中 由a点到b点的溶液pH变小,b点时Ph=7 稀硫酸(或硫酸、酸) 将反应过程中溶液酸碱性的变化显性化(合理均可) 取反应后的溶液放入蒸发皿中加热,直至水分蒸发、有自色固体析出,并检验析出的白色固体是硫酸钠(合理均可)
(2)不正确,因为固体NaOH溶于水会放热,所以温度也会升高 正确,中和反应是酸和碱相互交换成分而生成盐和水的放热反应 不正确,稀盐酸和氯化钠与硝酸银反应都产生白色沉淀,不能说明稀盐酸和氢氧化钠溶液发生了化学反应(合理均可)
(3) 参加反应的酸与碱的溶质的质量(合理均可)
(4)用氢氧化镁中和过多的胃酸/用熟石灰中和土壤的酸性(合理均可)
【解析】(1)根据图像可知,反应前溶液的pH大于7,反应过程中溶液的pH逐渐变小,直至小于7,氢氧化钠溶液呈碱性,硫酸呈酸性,所以该实验的试剂滴加方法是将稀硫酸逐滴滴入盛有一定量溶液的烧杯中;证明酸和碱发生了中和反应的依据是由a点到b点的溶液pH变小,b点时Ph=7;稀硫酸与NaOH溶液发生了中和反应,并且硫酸过量;反思:上述方案的设计思想是将反应过程中溶液酸碱性的变化显性化(合理均可);中和反应是酸和碱相互交换成分而生成盐和水的反应,要确认稀硫酸与NaOH溶液发生的反应是中和反应,还需要增补的实验步骤是取反应后的溶液放入蒸发皿中加热,直至水分蒸发、有自色固体析出,并检验析出的白色固体是硫酸钠(合理均可);(2)方案①:不正确,因为固体NaOH溶于水会放热,所以温度也会升高;方案②:正确,中和反应是酸和碱相互交换成分而生成盐和水的放热反应;方案③:不正确,稀盐酸和氯化钠与硝酸银反应都产生白色沉淀,不能说明稀盐酸和氢氧化钠溶液发生了化学反应(合理均可);(3)根据表中数据可知,A、B、C、D、E的五只烧杯中装入的盐酸中的溶质质量不同,影响中和反应放出热量多少的因素是参加反应的酸与碱的溶质的质量(合理均可);(4)中和反应在生活或生产中的一项应用是用氢氧化镁中和过多的胃酸/用熟石灰中和土壤的酸性(合理均可)。