有一包白色固体,可能含氯化钠、碳酸钠、硫酸钠、氢氧化钠、氢氧化钡中的一种或几种。 为了研究该混合物的成分,某同学按下列流程进行了实验( 各步均恰好完全反应);
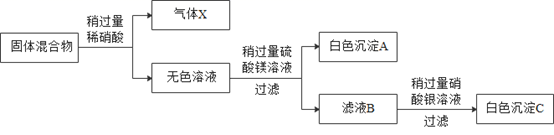
回答下列问题:
(1)气体X的化学式____,白色沉淀C的化学式__。
(2)生成白色沉淀A的化学方程式为____。
(3)通过流程图分析原固体中一定不含有的物质是____。
(4)为探究固体混合物中是否含有氢氧化钠及质量,某研究性学习小组取固体混合物样品40.0g,按上述流程图进行实验,结果产生白色沉淀A23.3g,白色沉淀C28.7g,气体X2.2g。通过以上数据计算确定固体混合物中___ (填字母序号)。
A 含有氢氧化钠
B 不含氢氧化钠
C 氢氧化钠为4.0g
D 氢氧化钠为5.9g
答案
CO2 AgCl Ba(NO3)2+MgSO4=Mg(NO3)2+BaSO4↓ Na2SO4 AD
【分析】
混合固体加入过量稀硝酸产生气体和无色溶液(含有氢离子,没有氢氧根),说明样品中一定含有碳酸钠,无色溶液(没有氢氧根)中加入硫酸镁产生白色沉淀A和滤液B,白色沉淀一定是硫酸钡,则无色溶液中一定有钡离子,固体中一定有氢氧化钡;无色溶液中一定没有硫酸根,固体中一定没有硫酸钠,滤液B加入硝酸银产生只能产生氯化银白色沉淀,滤液B中一定有氯离子,固体中一定有氯化钠;
【详解】
(1)只由碳酸钠能与稀硝酸反应产生二氧化碳气体,气体X的化学式:CO2,滤液B中加入硝酸银,产生白色氯化银沉淀,白色沉淀C的化学式:AgCl。
(2)硝酸钡和硫酸镁反应产生硝酸镁和硫酸钡白色沉淀的化学方程式为:Ba(NO3)2+MgSO4=Mg(NO3)2+BaSO4↓。
(3)通过流程图分析原固体中一定不含有的物质是:硫酸钠;因为硫酸钠能与氢氧化钡产生硫酸钡白色沉淀,不溶于硝酸;
(4)为探究固体混合物中是否含有氢氧化钠及质量,某研究性学习小组取固体混合物样品40.0g,按上述流程图进行实验,结果产生白色沉淀硫酸钡23.3g;白色沉淀氯化银28.7g;二氧化碳气体2.2g。
由钡元素质量守恒可知:氢氧化钡的质量=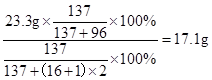 ;
;
由氯元素质量守恒可知:氯化钠的质量=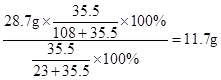 ;
;
由碳元素质量守恒可知:碳酸钠的质量=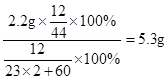 ;
;
氢氧化钠的质量=40.0g-17.1g-11.7g-5.3g=5.9g
通过以上数据计算确定固体混合物中:含有氢氧化钠5.9g;
故选:AD。