硫酸镁溶液可以和氢氧化钠溶液反应,该反应前后溶液中主要存在的离子(每种图形代表不同离子)如图所示。

(1)该实验过程中可以观察到的现象是______________
(2)图示中“![]() ”的离子符号是___________,滴管中盛放的是_________溶液(填化学式)。
”的离子符号是___________,滴管中盛放的是_________溶液(填化学式)。
(3)氨水(NH3•H2O)也能和硫酸镁反应,原因是氨水和氢氧化钠溶液中均含有一种相同离子,该离子是___________。(填离子符号)
(4)某同学用镁粉溶于100g稀硫酸反应得到的溶液和溶质质量分数为20%的氢氧化钠溶液恰好充分反应,沉淀经过滤、洗涤、干燥后称量,测得质量为5.8g。写出生成沉淀的化学方程式并计算消耗氢氧化钠溶液的质量(列式计算)。________
答案
有白色沉淀生成 Mg2+ NaOH OH- 2NaOH+MgSO4=Mg(OH)2↓+Na2SO4,消耗氢氧化钠溶液的质量为40g
【分析】
氢氧化钠和硫酸镁反应生成氢氧化镁沉淀和硫酸钠。
根据图像分析可知,反应后是硫酸钠溶液,硫酸钠在水溶液中电离出2个钠离子和1个硫酸根离子,则![]() 是硫酸根离子,
是硫酸根离子,![]() 是钠离子。则
是钠离子。则![]() 是氢氧根离子,
是氢氧根离子,![]() 是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。
是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。
【详解】
(1)氢氧化钠和硫酸镁反应生成氢氧化镁沉淀和硫酸钠,观察到的现象是溶液中有白色沉淀生成。故答案为:有白色沉淀生成;
(2)通过分析可知,图中![]() 表示的是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。故答案为:Mg2+、NaOH;
表示的是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。故答案为:Mg2+、NaOH;
(3)氨水属于碱,和氢氧化钠在水溶液中均能电离出氢氧根离子。故答案为:OH-;
(4)设消耗氢氧化钠的质量为x。
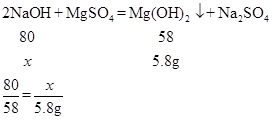
解得x=8g
则消耗氢氧化钠溶液的质量为:8g÷20%=40g。