酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
【实验探究Ⅰ】在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度______,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化。
②50mL一定浓度![]() 氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
③50mL一定浓度![]() 盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
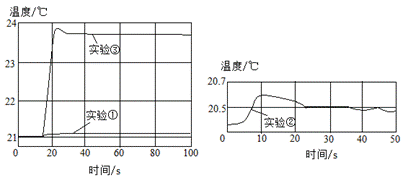
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示。
(1)由图可知,盐酸、氢氧化钠溶液稀释时均________(填“放热”或“吸热”),但它们稀释时温度的变化量远________两溶液混合时温度的变化量。
(2)从微观角度分析,此中和反应的温度变化主要是由于________(填离子符号)两种离子发生反应放出热量的缘故。
【实验探究Ⅱ】
(1)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。该反应的化学方程式为________。
(2)取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色。同学们对红色溶液中溶质的成分(酚酞除外)进行再探究。
查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。
作出猜想:猜想一:NaCl
猜想二:NaCl、NaOH
猜想三:NaCl、NaOH和Na2CO3
同学们讨论后一致认为猜想__________是错误的,理由是___________。
实验验证:取样,滴加_______,无气泡产生,猜想三错误。
原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在_______范围内,溶液的颜色变红。
总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色_____(填“一定”或“不一定”)变红。
答案
(1). 升高 (2). 放热 (3). 小于 (4). H+、OH- (5). ![]() (6). 三 (7). 反应物中不含碳元素 (8). 足量稀盐酸 (9). 8.2~14 (10). 不一定
(6). 三 (7). 反应物中不含碳元素 (8). 足量稀盐酸 (9). 8.2~14 (10). 不一定
【解析】(实验探究Ⅰ)在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,因中和反应放热,可观察到溶液的温度升高;
(1)由图可知,实验①、实验②中,溶液在稀释过程中温度都有上升,故盐酸、氢氧化钠溶液稀释时均放热,结合实验③曲线,可以发现盐酸、氢氧化钠溶液稀释时温度的变化量远低于两溶液混合时温度的变化量;
(2)从微观角度分析,此中和反应的温度变化主要是由于氢离子和氢氧根离子两种离子发生反应生成水分子放出热量的缘故,氢离子和氢氧根离子的离子符号分别是:H+、OH-。
(实验探究Ⅱ)
(1)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。氢氧化钠和盐酸反应生成氯化钠和水,该反应的化学方程式为:![]() ;
;
(2)根据质量守恒定律可知,反应前后元素种类不变,因此猜想三是错误的,理由是反应物中没有碳元素;
实验验证:取样,滴加足量的稀盐酸,无气泡产生,猜想三错误,因为碳酸钠能和盐酸反应生成二氧化碳气体,产生气泡;(本题中用足量的稀硫酸、稀硝酸均可)
原因分析:由资料可知,酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。反应后无色溶液中仍存在少量NaOH,加热蒸发,随着溶剂水的不断减少,氢氧化钠的浓度逐渐增大,溶液的pH逐渐增大,当溶液的pH在8.2<pH<14范围内,溶液的颜色变红;
总结反思:根据资料,酚酞在pH<8.2的溶液中呈无色,如果碱性溶液的pH<8.2,滴加酚酞溶液,溶液的颜色就不会变红。因此向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色不一定变红。