化学小组同学在查阅“氢氧化钠使酚酞变红的原因”时,看到了以下资料:
①实验室所用酚酞溶液pH<8。酚酞的分子结构受pH影响,酚酞溶液的颜色受其分子结构影响,具体情况如下表所示。
| 溶液的pH | 1≤pH<8 | 8≤pH≤13 | pH>13 |
| 酚酞的分子结构 | 内酯式 | 醌式 | 羧酸式 |
| 酚酞溶液的颜色 | 无色 | 红色 | 无色 |
②醌式结构的酚酞能与H2O2溶液发生反应,生成无色物质,且该物质在溶液中的颜色不受pH影响。
③NaOH溶液浓度越大,溶液pH越高。
该小组同学对上述资料产生了兴趣,决定对酚酞溶液颜色的变化开展探究。
【进行实验】
| 组别 | 实验操作 | 实验现象及数据 |
| 1 | 1-1:配制pH=13的NaOH溶液,取5 mL于试管中,向其中滴加2滴酚酞溶液后,分成两等份 |
|
| 1-2:向一支试管中加入稀盐酸 | 溶液红色褪去 | |
| 1-3:向另一支试管中加入 | 溶液红色褪去 | |
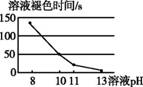
| 2 | 2-1:分别配制pH=8、10、11、13的NaOH溶液,各取5 mL分别加入4支试管中,再分别向4支试管中加入5滴30%H2O2溶液,最后各滴入2滴酚酞溶液 | 溶液都先变成红色,然后红色逐渐褪去,4支试管变化情况如下:
|
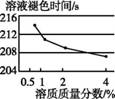
| 2-2:配制pH=9的NaOH溶液,分别取5 mL加入4支试管中,再向各试管中加入5滴质量分数分别为0.5%、1%、2%、4%的H2O2溶液,最后各滴入2滴酚酞溶液 | 溶液都先变成红色,然后红色逐渐褪去,4支试管变化情况如下:
|
【解释与结论】
(1)实验1-1中,可以观察到的实验现象是 。
(2)实验1-2中,溶液红色褪去的原因是 (用化学方程式表示)。
(3)实验1-3的目的是验证pH>13时,红色酚酞溶液会变成无色,则“向另一支试管中加入 ”。
(4)由实验2-1可以得到结论:H2O2能使变红的酚酞褪色, 。
(5)实验2-2的目的是 。
答案
(1)溶液变红 (2)NaOH+HCl![]() NaCl+H2O
NaCl+H2O
(3)一定量的NaOH固体
(4)且pH越大,溶液褪色所需时间越短
(5)探究过氧化氢溶液浓度对变红后的酚酞溶液褪色所需时间(或快慢)的影响
【解析】(1)pH=13时,向NaOH溶液中滴加酚酞溶液,酚酞溶液呈红色。(2)溶液红色褪去是因为氢氧化钠和盐酸发生反应生成了氯化钠和水,反应的化学方程式为NaOH+HCl![]() NaCl+H2O。(3)使氢氧化钠溶液的碱性增强,可采用增加溶质的方法。(4)由实验2-1可以得到结论:H2O2能使变红的酚酞褪色,且pH越大,溶液褪色所需时间越短。(5)实验2-2中其他条件一致,仅有过氧化氢溶液浓度一个变量,故实验2-2的目的是探究过氧化氢溶液浓度对变红后的酚酞溶液褪色所需时间(或快慢)的影响。
NaCl+H2O。(3)使氢氧化钠溶液的碱性增强,可采用增加溶质的方法。(4)由实验2-1可以得到结论:H2O2能使变红的酚酞褪色,且pH越大,溶液褪色所需时间越短。(5)实验2-2中其他条件一致,仅有过氧化氢溶液浓度一个变量,故实验2-2的目的是探究过氧化氢溶液浓度对变红后的酚酞溶液褪色所需时间(或快慢)的影响。