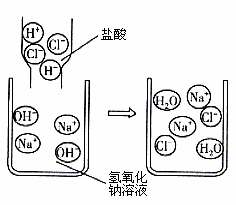
众所周知,酚酞溶液遇NaOH溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
【提出问题】分组实验中,出现意想不到现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成。
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关。
Ⅱ.红色褪去,与NaOH溶液的浓度有关。
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关。
【进行实验】
| 实验 | 实验操作 | 实验现象 | |
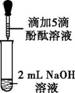
| 1 | 向盛有2 mL Na2CO3溶液的试管中滴加5滴0.5%的酚酞溶液 | 溶液变红 | |
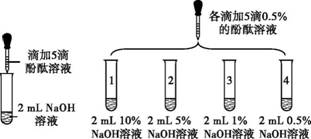
| 2 |
| 1号试管 | 0.1 min红色褪去 |
| 2号试管 | 5 min红色褪去 | ||
| 3号试管 | 30 min红色明显变浅 | ||
| 4号试管 | 120 min红色无明显变化 | ||
| 3 | 取3支试管,分别加入2 mL水,…… | 酚酞溶液浓度/% | 浑浊程度 |
| 5 | 大量浑浊物 | ||
| 2 | 少量浑浊物 | ||
| 0.5 | 无浑浊物 | ||
【解释与结论】
(1)NaOH与CO2反应的化学方程式为 。
(2)实验1的现象表明,猜想与假设Ⅰ (填“成立”或“不成立”)。
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是 。
(4)实验3的操作步骤:取3支试管,分别加入2 mL水, 。
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为0.5%,建议选用NaOH溶液的浓度为 %。
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是 。
答案
(1)2NaOH+CO2![]() Na2CO3+H2O
Na2CO3+H2O
(2)不成立
(3)NaOH溶液的浓度越大,溶液变红后褪色越快
(4)各滴加5滴浓度为5%、2%、0.5%的酚酞溶液
(5)0.5
(6)未考虑NaOH与出现白色浑浊物是否有关(合理即可)

 Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑