我市覃塘区石灰石资源丰富,某石灰厂为了测定某石灰石样品中CaCO3的质量分数,往盛有300g稀盐酸的烧杯中依次加入粉碎后的石灰石样品(杂质不与盐酸反应),充分反应后,实验数据记录如下:
实验次数 第一次 第二次 第三次 第四次
石灰石样品/g 25 15 10 5
烧杯中物质总质量/g 316.2 326.8 m 337.4
(1)CaCO3中钙、碳、氧三种元素的质量比为多少;(写最简比)
(2)表中m= ;
(3)所用稀盐酸的溶质质量分数为多少;
(4)求该石灰石样品中CaCO3的质量分数。(写出计算过程)
10:3:12;332.4;9.7%;80%
【解析】(1)CaCO3中钙、碳、氧三种元素的质量比为40:12:(16×3)=10:3:12;
第一次:生成二氧化碳的质量为25g+300g-316.2g=8.8g;设第一次加入25g样品中碳酸钙的质量为x,则


解得x=20g;
该石灰石样品中CaCO3的质量分数为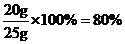 ;
;
第四次加入样品后,累计生成二氧化碳的质量为25g+15g+10g+5g+300g-337.4g=17.6g,设生成17.6g二氧化碳需要石灰石样品的质量为y,消耗稀盐酸溶质质量为z,则
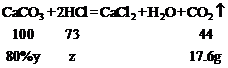
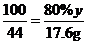 ,
,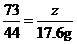
解得y=50g,z=29.2g;
恰好为前三次加入样品的总质量,即第三次加入样品后,稀盐酸恰好完全反应,故m=50g+300g-17.6g=332.4g;
所用稀盐酸的溶质质量分数为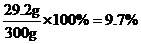 ;
;
答:CaCO3中钙、碳、氧三种元素的质量比为10:3:12;表中m=332.4;所用稀盐酸的溶质质量分数为9.7%;该石灰石样品中CaCO3的质量分数为80%。
某校甲、乙兴趣小组同学在学习酸、碱、盐、金属的化学性质后,分别做了A、B、C三组实验:
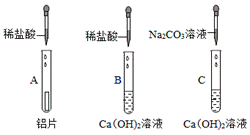
甲、乙小组同学都观察到C组实验的现象为________。
实验结束后,甲、乙小组同学分别同时将三组实验反应后的物质各倒入一个洁净的烧杯中,都观察到有气泡产生,甲、乙小组同学分别对气体成分及充分反应后烧杯中溶液的溶质成分进行探究。
【查阅资料】
①![]()
② ![]()
③![]()
![]() 实验探究】
实验探究】
| 实验操作 | 实验现象 | 实验结论 | ||
| 甲组 | 取少量烧杯中的溶液于试管中,滴入紫色石蕊溶液 | 紫色石蕊溶液变红色 | 气体为CO2、H2;溶液中溶质一定含有AlCl3、NaCl、___、HCl | |
| 乙组 | 分别取少量烧杯中的溶液于两支试管中 | 往一支试管中先滴入足量BaCl2溶液,再滴入无色酚酞溶液 | 只观察到溶液变红色 | 气体为H2;溶液中溶质一定含有NaAlO2、NaCl、NaOH |
| 往另一支试管中不断滴入稀盐酸 | _____ | |||
【交流与反思】
(1)乙小组同学讨论后认为,甲组同学得出气体成分的结论不严谨,其理由是______。
(2)甲、乙小组同学所做实验相同,得出的实验结论却不同,原因是________。
【拓展与应用】只用一条化学方程式表示AlCl3与过量NaOH在溶液中的反应:____。
(1). 产生白色沉淀 (2). CaCl2 (3). 一开始无明显现象,后产生白色沉淀 (4). 紫色石蕊试液变红,溶液显酸性,碳酸钙一定与稀盐酸反应生成了二氧化碳,但是仅凭有气泡产生,无法得出产生了氢气 (5). 所用试剂的量不同 (6). ![]()
【解析】碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,故观察到产生白色沉淀;
实验探究:甲组:取少量烧杯中的溶液于试管中,滴入紫色石蕊溶液,紫色石蕊溶液变红色,紫色石蕊试液遇酸变红,紫色石蕊试液变红色,说明溶液显酸性,A:铝与稀盐酸反应生成氯化铝和氢气;B:氢氧化钙和稀盐酸反应生成氯化钙和水;C:碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,烧杯中溶液显酸性,说明稀盐酸过量,故产生的氢氧化钠和稀盐酸反应生成了氯化钠和水,碳酸钙和稀盐酸也反应生成了氯化钙、二氧化碳和水,故溶液中溶质一定含有AlCl3、NaCl、CaCl2、HCl;
乙组:分别取少量烧杯中的溶液于两支试管中,往一支试管中先滴入足量BaCl2溶液,再滴入无色酚酞溶液,只观察到溶液变红色,氯化钡能与碳酸钠反应生成碳酸钡和氯化钠,没有观察到白色沉淀产生,说明溶液中不含碳酸钠,无色酚酞试液遇碱变红,溶液变红色,说明溶液显碱性,实验结论为:气体为H2;溶液中溶质一定含有NaAlO2、NaCl、NaOH,故往另一支试管中不断滴入稀盐酸,氢氧化钠先与稀盐酸反应生成氯化钠和水,待完全反应后,![]() ,故实验现象为:一开始无明显现象,后产生白色沉淀;
,故实验现象为:一开始无明显现象,后产生白色沉淀;
交流与反思:(1)由分析可知,紫色石蕊试液变红,溶液显酸性,碳酸钙一定与稀盐酸反应生成了二氧化碳,但是仅凭有气泡产生,无法得出产生了氢气;
(2)甲、乙小组同学所做实验相同,得出的实验结论却不同,原因是:所用试剂的量不同;
拓展与应用:氯化铝与氢氧化钠反应:![]() ,
,![]() ,故只用一条化学方程式表示AlCl3与过量NaOH在溶液中的反应为:
,故只用一条化学方程式表示AlCl3与过量NaOH在溶液中的反应为:![]() 。
。
根据下列装置回答问题:
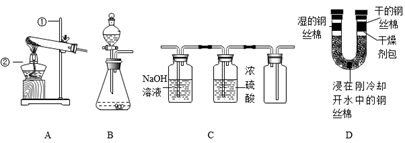
(1)写出标号仪器的名称:①_______;②______。
(2)实验室用装置B制取氧气的化学方程式为________。
(3)下列混合气体(括号内气体为杂质)能用装置C进行除杂、干燥、收集的是_____(填序号)。
①O2(CO2)
②CO2(HCl)
③NH3(O2)
④H2(H Cl)
(4)利用装置D进行实验探究得出铁生锈的条件是____;若U形管水中的丝棉也产生少量锈迹,说明该实验还需改进,你的改进方法是______________。
(1). 铁架台 (2). 酒精灯 (3). ![]() (4). ④ (5). 铁与氧气和水直接接触 (6). 在盛有凉开水的U型管两边的液面上滴加植物油
(4). ④ (5). 铁与氧气和水直接接触 (6). 在盛有凉开水的U型管两边的液面上滴加植物油
【解析】(1)标号①的名称是:铁架台;标号②的名称是:酒精灯;
(2)装置B适用于固液不加热反应制取气体,故适用于过氧化氢和二氧化锰制取氧气,过氧化氢在二氧化锰的催化下分解为水和氧气,该反应的化学方程式为:![]() ;
;
(3)①O2(CO2):二氧化碳能与氢氧化钠反应生成碳酸钠和水,氧气与氢氧化钠不反应,且氧气不与浓硫酸反应,可用浓硫酸干燥,但是氧气的密度比空气大,收集时,应从长管进入,不符合题意;
②CO2(HCl):二氧化碳和氯化氢都能与氢氧化钠反应,不但除去了杂质,也除去了原物质,不符合题意;
③NH3(O2):氨气能与浓硫酸反应,不能用浓硫酸干燥,且氧气与氢氧化钠不反应,达不到除杂的目的,不符合题意;
④H2(H Cl):氢氧化钠能与氯化氢反应生成氯化钠和水,与氢气不反应,且氢气与浓硫酸不反应,可用浓硫酸干燥,氢气的密度比空气小,收集时,可从短管进入,符合题意。
故选④;
(4)潮湿的钢丝棉与空气接触,生锈,干燥的钢丝棉与空气接触,不生锈,说明铁生锈的条件之一是与水接触,潮湿的钢丝棉与空气接触,生锈,水底的钢丝棉与空气隔绝,不生锈,说明生锈的条件是与空气(或氧气)接触,故铁生锈的条件是:铁与氧气和水直接接触;
若U形管水中![]() 丝棉也产生少量锈迹,说明少量的氧气溶解在水中,使钢丝棉生锈,可在盛有凉开水的U型管两边的液面上滴加植物油,隔绝空气(或氧气)。
丝棉也产生少量锈迹,说明少量的氧气溶解在水中,使钢丝棉生锈,可在盛有凉开水的U型管两边的液面上滴加植物油,隔绝空气(或氧气)。
一包不纯的氯化钾粉末,杂质可能是硫酸钠、氢氧化钠、氯化钠、硝酸钡中的一种或几种。为确定其成分,某兴趣小组的同学进行如下实验:
实验一:取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得到无色澄清溶液,往溶液中通入CO2,产生白色沉淀。
实验二:取14.0g该粉末于烧杯中,加入蒸馏水完全溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后,产生28.7g白色沉淀。
根据以上信息,回答下列问题:
(1)杂质中一定没有___________,一定有__________。
(2)实验一中产生白色沉淀的化学方程式为_____________。
(1). 硫酸钠 (2). 氢氧化钠、硝酸钡、氯化钠
(3). ![]()
【解析】实验一:
取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得到无色澄清溶液,不可能同时含有硫酸钠和硝酸钡,往溶液中通入CO2,产生白色沉淀,可知一定含氢氧化钠和硝酸钡,二氧化碳先与氢氧化钠反应生成碳酸钠和水,碳酸钠与硝酸钡反应生成碳酸钡沉淀和硝酸钠,则一定不含硫酸钠。
实验二:
取14.0g该粉末于烧杯中,加入蒸馏水完全溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后,产生28.7g白色沉淀,不溶于稀硝酸的白色沉淀为氯化银,氯离子只能来自氯化钾或氯化钠;
设14g氯化钾与硝酸银充分反应生成氯化银沉淀的质量为x,则
 27
27
![]()
解得x=27g<28.7g;
设14g氯化钠与硝酸银充分反应生成氯化银沉淀的质量为y,则
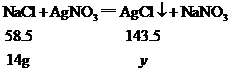 34.3
34.3
![]()
解得y=34.3g>28.7g;可知一定含有氯化钠;
(1)综上所述,杂质中一定含氢氧化钠、硝酸钡、氯化钠,一定不含硫酸钠。
(2)实验一中产生白色沉淀的反应为碳酸钠与硝酸钡反应生成碳酸钡沉淀和硝酸钠,反应的化学方程式为![]() 。
。
众志成城,抗击新冠,新冠肺炎疫情在我国已得到了有效控制。请用所学的化学知识回答下列问题:
(1)用“84消毒液”对校园环境进行消杀工作,消毒时会闻到刺激性气味,其原因是微粒在__; “84消毒液”的有效成分是次氯酸钠(NaClO),次氯酸钠由______种元素组成,其中氯元素的化合价为____价。
(2)火神山医院的建成向世界展示了“中国速度”。建设过程中用到挖掘机,挖掘机常用柴油作燃料,柴油燃烧时将_____能转化为热能,挖掘机铲斗是用合金制成的,主要利用了合金的_____物理性质;用HDPE防渗膜为医院地下基础穿上“防护服”,HDPE是一种高密度聚乙烯塑料,其属于___材料。
(1). 不断的运动 (2). 3 (3). +1 (4). 化学 (5). 硬度大 (6). 合成
【解析】(1)可以个很远就能闻到气味是因为分子在不断的运动;从次氯酸钠的化学式NaClO可知,次氯酸钠是由Na、Cl、O3种元素组成;次氯酸钠中,钠元素显+1价,氧元素显-2价,设次氯酸钠中氯元素的化合价为x,根据化合物中各元素的化合价代数和为零,则有:(+1)+x+(-2)=0,x=+1,次氯酸钠中氯元素的化合价为+1价;
(2)燃烧是将柴油的化学能转化成为热能;合金对比纯金属有硬度大、熔点低的优点,铲斗主要用于铲土,因此利用的是合金硬度大的物理性质;高密度聚乙烯塑料属于合成材料;
故答案为:不断的运动;3;+1;化学;硬度大;合成。
本卷还有17题,登录并加入会员即可免费使用哦~

该作品由: 用户王中国分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。