硫酸钾是重要的化工原料,在生产过程中常混有氯化钠杂质。
(1) 用洁净的铂丝蘸取 NaCl 溶液灼烧,火焰呈 色。取少量 K 2 SO 4 溶液,滴入 BaCl 2 溶液,现象是 ,反应的化学方程式是 。
(2) 硫酸钾和氯化钠的部分溶解度数据如有下表。 100℃ 时, NaCl 的溶解度为 g/100g 水; 20℃ 时, 10g 水中最多溶解 K 2 SO 4 g 。
溶解度 (g/100g 水 )
| 温度 (℃) | 0 | 20 | 60 | 100 |
| NaCl | 35.7 | 36.0 | 37.1 | 39.2 |
| K 2 SO 4 | 7.4 | 11.1 | 18.2 | 24.1 |
(3) 某 K 2 SO 4 样品中混有 NaCl 杂质,可利用溶解度差异进行提纯。称取 27.5g 样品进行实验,过程如下:
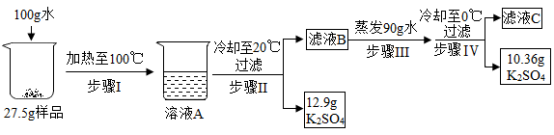
i. 溶液 B 中, K 2 SO 4 ( 选填 “ 达到 ” 或 “ 未达到 ”) 饱和状态。
ii.27.5g 样品中 NaCl 的质量是 g 。
iii. 析上述实验,说明设计步骤 II 对后续操作的作用: 。
答案
(1) 黄 产生白色沉淀
(2) 39.2 1.11
(3) 达到 3.5 根据步骤 II 的结果,可知样品中硫酸钾和氯化钠的质量;结合溶解度数据,获得较多硫酸钾
【详解】( 1 )钠的焰色反应是黄色,所以用洁净的铂丝蘸取 NaCl 溶液灼烧,火焰呈黄色;
硫酸钾和氯化钡反应生成硫酸钡沉淀和氯化钾,则现象是产生白色沉淀,化学方程式是 。
( 2 )由表中数据可知, 100℃ 时, NaCl 的溶解度为 39.2g ;
20℃ 时, K 2 SO 4 的溶解度为 11.1g ,则该温度下 10g 水中最多溶解 K 2 SO 4 。
( 3 ) i 、析出晶体后的溶液是饱和溶液,所以滤液 B 中, K 2 SO 4 达到饱和状态;
ii 、 20°C 时,硫酸钾的溶解度是 11.1g ,而溶液 B 为硫酸钾的饱和溶液,所以 27.5g 样品中 NaCl 的质量是 27.5g -12.9g-11.1g=3.5g ;
iii 、结合前面分析和实验过程,可知根据步骤 II 的结果,可知样品中硫酸钾和氯化钠的质量,结合溶解度数据,获得较多的硫酸钾。