20 .某校学生用盐酸和碳酸钙制备 CO 2 ,产生了大量废液。兴趣小组通过以下探究确定废液处理方案。
( 1 )废液成分的确定
① 写出制备 CO 2 的化学方程式 _______ 。
② 推测废液所含溶质
推测一: _______ 推测二: CaCl 2 和 HCl
③ 若要用一种药品验证哪种推测成立,可选择的有哪些? _______( 填标号 )
A .石蕊溶液 B . AgNO 3 溶液 C .锌粒 D . CuO 粉末
( 2 )废液的处理
实验表明废液中的溶质是 CaCl 2 和 HCl ,小组决定用 Na 2 CO 3 除去它们。
【提出问题】如何估算 Na 2 CO 3 固体的用量?
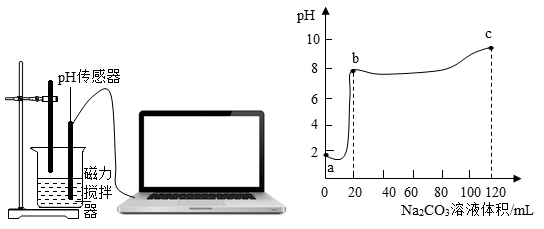
【进行实验】取 100mL 废液样品于烧杯中,逐滴滴加 5.3% 的 Na 2 CO 3 溶液,用 pH 传感器测定滴加过程中溶液的 pH 。实验结果如图所示。
【结果讨论】
①a→b 阶段,观察到烧杯中的现象是 _______ 。
②b 点后曲线平缓阶段,反应的化学方程式为 _______ 。
③c 点时,取少量烧杯中的清液于试管中,滴加 CaCl 2 溶液,有白色沉淀生成,说明处理 100mL 废液,所需 5.3% 的 Na 2 CO 3 溶液的体积 _______120mL 。 ( 填 “ 大于 ”“ 等于 ” 或 “ 小于 ”)
④ 将烧杯中的沉淀过滤、干燥、称重,质量为 4g 。若处理 10L 该废液,理论上需要 Na 2 CO 3 固体 ___g 。 ( 实验所用 Na 2 CO 3 溶液的密度近似看做 1g/cm 3 )
答案
CaCl 2 ACD 有气泡产生
小于 530
【详解】( 1 ) ① 实验室用大理石(或 石灰石)和稀盐酸制取 CO 2 ,大理石的主要成分碳酸钙和盐酸反应产生氯化钙、水和二氧化碳,化学方程式: 。
② 碳酸钙和盐酸恰好完全反应时溶质只有氯化钙,则推测一:氯化钙;盐酸过量时推测二: CaCl 2 和 HCl ;
③ 根据推测,主要是证明盐酸的有无即可判断是哪种推测;
A 、盐酸会使石蕊试液变红色;则样品滴加石蕊试液后变红了,则有盐酸,推测二成立;如果石蕊试液不变色,推测一成立;正确;
B 、溶液中有氯化钙,提供了氯离子,硝酸银和氯化钙反应产生氯化银沉淀和硝酸,盐酸和硝酸银也会产生氯化银沉淀,所以不能用硝酸银溶液验证是否有盐酸,错误;
C 、盐酸和锌反应产生氯化锌和氢气,会产生气体;则锌粒中加入样品后产生气泡,则有盐酸,推测二成立;如果没有气泡,推测一成立;正确;
D 、氧化铜和盐酸反应产生氯化铜和水,固体会减少或消失,溶液变蓝色;则氧化铜中加入样品后固体会减少或消失,溶液变蓝色,则有盐酸,推测二成立;如果固体不减少,溶液不变蓝色,推测一成立;正确;故选 ACD 。
( 2 ) ① 废液中的溶质是 CaCl 2 和 HCl ,向其中加入碳酸钠,碳酸钠先和盐酸反应产生氯化钠、水和二氧化碳,然后碳酸钠和氯化钙反应产生碳酸钙沉淀和氯化钠,根据图像 a→b 阶段,是碳酸钠和盐酸反应,则会观察到烧杯中有气泡产生。
② 碳酸钠溶液显碱性, b 点后曲线平缓阶段,是碳酸钠和氯化钙反应,氯化钠溶液显中性,反应的化学方程式为: 。
③c 点时,溶液显碱性,碳酸钠过量,结合图像分析,说明处理 100mL 废液,所需 5.3% 的 Na 2 CO 3 溶液的体积小于 120mL 。
④100mL 废液,产生碳酸钙的质量是 4g ,设要碳酸钠的质量是 x 。
所需碳酸钠溶液的体积为: 4.24g÷5.3%÷1g/mL=80mL , 即 80mL 碳酸钠溶液中含有碳酸钠 4.24g ,故 100mL 碳酸钠溶液中含有碳酸钠 4.24g×100mL÷80mL=5.3g ,因此若处理 10L (即: 10000mL )该废液,理论上需要 Na2CO3 固体质量为 10000mL÷100mL×5.3g=530g ;
故答案为: 530 。