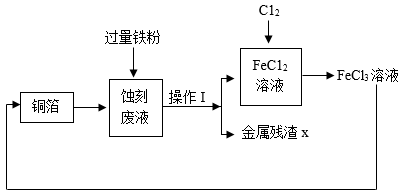
工业上用 FeCl 3 溶液蚀刻铜箔制造印刷电路板,反应为 ,蚀刻废液又可再处理,实现资源回收和循环利用,其流程转化关系如下。
请回答相关问题。
(1)“ 蚀刻废液 ” 的全部溶质有 ____________ 和少量 FeCl 3 。操作 I 的名称是 ____________ 。
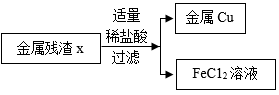
(2) 参照上述流程,画出由 “ 金属残渣 x” 分离回收 Cu 和 FeC1 2 溶液的简单流程图。
(3) 上述流程中,能使三价铁转化为二价铁的物质有 ____________ 。
(4) 蚀刻掉 128g 铜,消耗 FeCl 3 的质量为 ____________ g ,理论上至少需要 20%FeCl 3 溶液的质量为 ____________ g 。(不需要写出计算过程)
答案
(1) 过滤
(2) 
(3) 铜和铁
(4) 650 3250
【详解】( 1 ) FeCl 3 与 Cu 反应生成氯化亚铁和氯化铜,故 “ 蚀刻废液 ” 的全部溶质有 和少量 FeCl 3 。操作 I 为固液分离,为过滤操作;
( 2 ) “ 蚀刻废液 ” 中的氯化铜与过量的铁粉反应生成铜和氯化亚铁,经过操作 I 过滤得到滤液为氯化亚铁,金属残渣为过量的铁和生成的铜,金属残渣中加入适量的稀盐酸,盐酸与过量的铁反应生成氯化亚铁和氢气,而铜与盐酸不反应,则可达到由 “ 金属残渣 x” 分离回收 Cu 和 FeC1 2 溶液,流程图见答案;
( 3 )上述流程中,有 , “ 蚀刻废液 ” 中有少量的氯化铁,加入过量的铁粉,可以使氯化铁转化为氯化亚铁,故可以使三价铁转化为二价铁的物质有铁和铜;
( 4 )设蚀刻掉 128g 铜,消耗 FeCl 3 的质量为 ,
解得
即消耗 FeCl 3 的质量为 650g ,则理论上至少需要 20%FeCl 3 溶液的质量为 。

 Cu+H2O
Cu+H2O 2Fe+3H2O
2Fe+3H2O 2Cu+CO2↑
2Cu+CO2↑ 4Fe+3CO2↑
4Fe+3CO2↑