根据图中 KNO 3 、 NaCl 的溶解度曲线,回答下列问题:
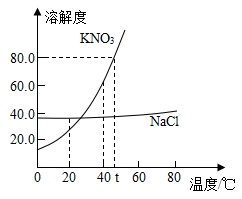
(1)40℃ 时, KNO 3 、 NaCl 两种物质的溶解度大小关系: KNO 3 _______NaCl( 填 “>”“<” 或 “=”) 。
(2) 下列说法不正确的是 ( 填字母 ) 。
A . t℃ 时,将 45gKNO 3 固体放入 50g 水中充分溶解,所得溶液的质量为 95g
B . NaCl 溶液中含有少量 KNO 3 ,可以采用蒸发结晶的方法提纯 NaCl
C . 40℃ 时,将 KNO 3 的饱和溶液降温至 20℃ ,溶液的溶质质量分数减小 ( 不考虑水分损失 )
(3) 同学们查阅 NaCl 的溶解度曲线后,欲配制 20℃ 时 100g 溶质质量分数为 10% 的 NaCl 溶液。已知配制溶液的步骤有: ① 溶解 ② 计算 ③ 装瓶存放 ④ 称量
I. 上述步骤的正确顺序为 _______( 填序号 ) 。
Ⅱ. 溶解时玻璃棒的作用为 _______ 。
答案
(1)>
(2)A
(3) ②④①③ 搅拌,加速物质溶解
【详解】( 1 )相同温度时,溶解度曲线上对应的点越高,溶解度越大,所以 40℃ 时, KNO 3 、 NaCl 两种物质的溶解度大小关系: KNO 3 >NaCl 。
( 2 ) A. t℃ 时硝酸钾的溶解度为 80g ,则 50g 水中最多溶解 40g 硝酸钾,得到溶液的质量为 40g+50g=90g 。错误。
B. 氯化钠、硝酸钾的溶解度均随温度的升高而升高。氯化钠溶解度受温度影响较小,硝酸钾溶解度受温度影响较大。所以 NaCl 溶液中含有少量 KNO 3 ,可以采用蒸发结晶的方法提纯 NaCl ,正确。
C. 硝酸钾溶解度随温度的减小而减小,降低温度硝酸钾饱和溶液又溶质析出,溶液的溶质质量分数减小。正确。
故选 :A 。
( 3 ) I. 配置一定溶质质量分数的溶液的步骤是计算、称量、溶解、装瓶存放。所以争取顺序为 ②④①③ 。
Ⅱ 溶解时玻璃棒的作用是搅拌,加速物质溶解。