如图是 A 、 B 、 C 三种物质的溶解度曲线,下列分析正确的是
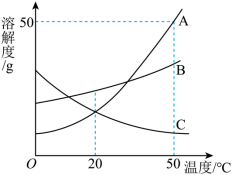
A . A 的溶解度比 B 大
B . 时把 50gA 放入 100g 水中能得到 A 的饱和溶液,其中溶质与溶液的质量比为
C .将 A 的饱和溶液变为不饱和溶液,可采用降温的方法
D .将 时 A 、 B 、 C 三种物质的饱和溶液降温至
时,这三种溶液的溶质质量分数的人小关系是
答案
D
【分析】由图可知, A 、 B 两种固体物质的溶解度都是随温度升高而增大,而 c 的溶解度随温度的升高而减少。
【详解】 A .由图可知, 50℃ 时, A 的溶解度比 B 大, 20℃ 时, B 的溶解度比 A 大,则未注明温度,无法比较 A 和 B 的溶解度,故 A 错误;
B .由图可知, 50℃ 时, A 的溶解度是 50g ,则将 50ga 物质放入 50g 水中充分溶解得到溶液的质量为 25g+50g=75g ,则溶质与溶液的质量比为 2∶3 ,故 B 错误;
C .由图可知, A 的溶解度随温度升高而增大,则将 A 的饱和溶液变为不饱和溶液,可采用升温的方法,故 C 错误;
D . 50℃ 时 A 、 B 、 C 三种物质溶解度由大到小是 A > B > C ,所以其饱和溶液的溶质质量分数由大到小的顺序为 A > B > C ,温度降温到 20℃ 时, A 、 B 仍为饱和溶液,且 B 的溶解度大于 A 的溶解度,都大于 C 物质 50℃ 时的溶解度,所以这三种溶液的溶质质量分数的大小关系是 B > A > C ,故 D 正确;
故选 D 。

 Cu + H2O。
Cu + H2O。 
 H2O+Cu
H2O+Cu