电导率是衡量溶液导电能力大小的物理量 , 在相同条件下 , 电导率与离子浓度 ( 单位体积内的离子数 ) 成正比 , 利用数据传感技术测定溶液电导率可辅助探究复分解反应。对如图所示实验分析不正确的是
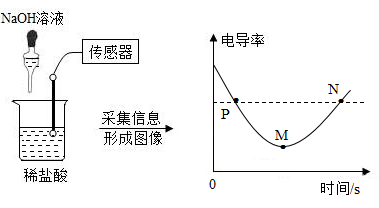
A . M 点时 NaOH 溶液与稀盐酸恰好完全反应
B . N 点时溶液中的离子数大于 P 点
C .电导率减小是由于溶液中离子数量逐渐减少
D .该实验证明溶液中始终含有带电的粒子
答案
C
【详解】 A 、氢氧化钠和稀盐酸反应生成氯化钠和水,反应过程中离子数目不变,但是溶液体积增加,故离子浓度降低,电导率降低,当恰好完全反应时,电导率最低,故 M 点时 NaOH 溶液与稀盐酸恰好完全反应,不符合题意;
B 、 N 点和 P 点的电导率相同,即离子浓度相同,但是溶液体积: P 点< N 点,故 N 点时溶液中的离子数大于 P 点,不符合题意;
C 、在相同条件下,电导率与离子浓度 ( 单位体积内的离子数 ) 成正比,故电导率减小是由于溶液中离子浓度逐渐减少,符合题意;
D 、反应过程中,该溶液始终具有导电性,说明溶液中始终含有带电的粒子,不符合题意。
故选 C 。