配制 100g 溶质的质量分数为 16% 的 NaCl 溶液。下列说法不正确的是
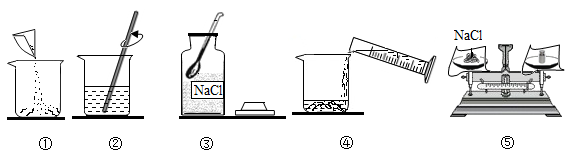
A .实验操作顺序为 ③⑤①④② B .配制好的溶液倒出 10ml ,剩余溶液浓度变小
C .需称量 NaCl 的质量为 16g D .选用 100ml 量筒量取所需的水
答案
B
【解析】
【详解】
A 、配制溶质质量分数为 16% 的 NaCl 溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,实验操作顺序为 ③⑤①④② ,故选项说法正确;
B 、配制好的溶液倒出 10mL ,剩余溶液浓度是不变的,因为溶液是均一的,故选项说法错误;
C 、溶质质量=溶液质量 x 溶质的质量分数,实验室配制 100g16% 的 NaCI 溶液,需氯化钠的质量 =100g×16%=16. 0g ,故选项说法正确;
D 、溶剂质量 = 溶液质量 - 溶质质量,所需氯化钠质量 =100g×16%=16g ,溶剂的质量为 100g-16. 0g=84. 0g( 合 84. 0mL) ,应用规格为 100mL 的量筒量取水的体积,故选项说法正确。
故选: B 。