某班级研究铁、铜、银的金属活动性,并回收 Ag 。
①判断铁、铜、银中金属活动性最强的是 _______ ;
② Cu 与 AgNO 3 反应的化学方程式 _______ ; Fe 与 Cu(NO 3 ) 2 反应后, Fe 表面析出 _______ 色固体;
③现有 Fe(NO 3 ) 2 、 Cu(NO 3 ) 2 、 AgNO 3 混合废液,目的回收 Ag :
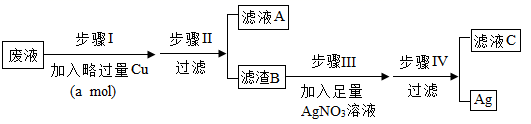
ⅰ . 滤液 A 的溶质是 _______ ;步骤 Ⅲ中加入足量 AgNO 3 溶液的目的是 _______ ;何确定滤液 C 中有 AgNO 3 ,应选 _______ 溶液;
ⅱ . 若将步骤 Ⅰ中的 amolCu 改为 amolFe ,最终得到 Ag 的质量是否会改变,请说明理由: ____ 。
答案
铁 (Fe) 红 硝酸亚铁和硝酸铜 使滤渣 B 中的铜完全反应,得到纯净的银 稀盐酸 不会改变,因为假设步骤 Ⅰ中加入的 amolFe 和足量的硝酸铜反应,会生成 amolCu ,那么 后续反应就和原来的 amol 略过量的 Cu 一样了,置换出银肯定是 2amol
【详解】
①在金属活动性顺序里,铁排在铜、银之前,故金属活动性最强的是 Fe ;;
②铜与硝酸银反应生成硝酸铜和银,该反应的化学方程式为: ;;
铁与硝酸铜反应生成硝酸亚铁和铜,铁表面析出红色固体;;
③ i. 在金属活动顺序中铜排在铁之后,银之前。加入稍过量铜,铜会与硝酸银反应生成银和硝酸铜,所以滤液 A 中溶质为硝酸铜和硝酸亚铁;
滤渣 B 中有银和稍过量的 Cu ,步骤 Ⅲ加入足量硝酸银,将铜反应成硝酸铜;
硝酸银与盐酸反应生成氯化银沉淀和硝酸。滤液 C 中一定有硝酸铜,是否有硝酸银,用盐酸检验,若有白色沉淀,则含硝酸银,反之不含。
ii. 如果把 amolCu 改为 amolFe ,首先依然会把混合废液中的 Ag 全部置换出来,额外还有一部分 Cu 也进入滤渣 B ,滤渣 B 中加入足量硝酸银, Cu 又把 Ag 置换出来。
铁与硝酸铜: , 1molFe 置换 1molCu ,铁和硝酸银:
, 1molFe 置换 2molAg ,铜和硝酸银:
1molCu 置换 2molAg ,铜和铁是等效的。所以最终都得到 2molAg ;

 Cu+H2O
Cu+H2O 2Fe+3H2O
2Fe+3H2O 2Cu+CO2↑
2Cu+CO2↑ 4Fe+3CO2↑
4Fe+3CO2↑