利用下列实验来探究![]() 气体的制取和性质。
气体的制取和性质。
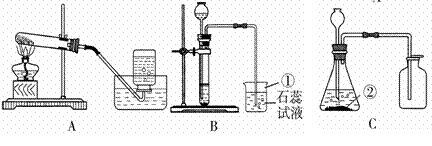
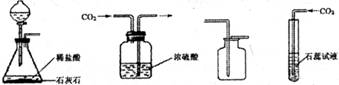
(1)A、B、C三套发生装置都可用于实验室制取![]() 气体。
气体。
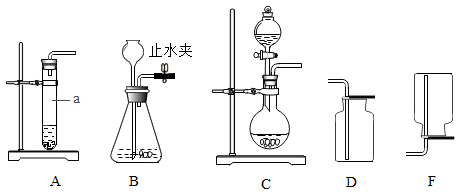
①仪器a的名称是_____。
②实验室制取![]() 的化学方程式是_____;收集
的化学方程式是_____;收集![]() 可选用的装置是_____(填序号),检验
可选用的装置是_____(填序号),检验![]() 收集满的方法是_____。
收集满的方法是_____。
③利用B装置制取![]() 时,反应未停止前关闭止水夹,可观察到的现象是_____。
时,反应未停止前关闭止水夹,可观察到的现象是_____。
④与A装置相比,利用C装置制取![]() 的优点是_____。
的优点是_____。
(2)某化学兴趣小组对![]() 的性质进行了探究。实验步骤如下:
的性质进行了探究。实验步骤如下:
步骤1:如图5所示装置的气密性良好(图中a处连接气体压力传感器),甲、乙、丙三个烧瓶的容积均为250mL,分别收集满![]() ,三个注射器内各装有85mL液体。
,三个注射器内各装有85mL液体。
步骤2:三位同学同时迅速将注射器内液体全部注入各自烧瓶中,关闭活塞;一段时间后,同时振荡烧瓶。
步骤3:利用“数字化实验”测定烧瓶内的气压变化,得到如图6所示的烧瓶内压强与时间的关系曲线图,曲线1、2、3分别表示甲、乙、丙三个烧瓶内的气压变化。

①实验过程中,观察到烧瓶乙中有白色沉淀生成。写出该反应的化学方程式:_____。
②曲线1中BC段气压逐渐变小的原因是_____,导致CD段气压快速变小的操作是_____。
③对比曲线1与曲线3,能得出的结论是_____(填序号)。
a.![]() 能溶于水
能溶于水
b.![]() 能与水发生反应
能与水发生反应
c.![]() 能与NaOH溶液发生反应
能与NaOH溶液发生反应
答案
试管 CaCO3+2HCl=CaCl2+H2O+CO2↑ D 将燃着的木条放在集气瓶口,若木条火焰熄灭,则集满 锥形瓶内液面下降,有液体回流到长颈漏斗中 可以随时添加液体药品,可以通过控制酸液的滴加速率达到控制反应速率的作用 CO2+Ca(OH)2=CaCO3↓+H2O CO2溶于水 振荡 ac
【解析】
(1)①图中仪器a的名称是:试管。
②实验室常用石灰石和稀盐酸反应制取![]() ,其化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;因为二氧化碳能溶于水,且密度比空气大,所以收集CO2可选用的装置是D:,检验CO2收集满的方法是:将燃着的木条放在集气瓶口,若木条火焰熄灭,则集满。
,其化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;因为二氧化碳能溶于水,且密度比空气大,所以收集CO2可选用的装置是D:,检验CO2收集满的方法是:将燃着的木条放在集气瓶口,若木条火焰熄灭,则集满。
③利用B装置制取CO2时,反应未停止前关闭止水夹,因为反应在继续进行,生成二氧化碳气体,瓶内压强增大,锥形瓶内的液体就会回流到长颈漏斗中,因此可观察到的现象是:锥形瓶内液面下降,有液体回流到长颈漏斗中。
④与A装置相比, C装置中使用了分液漏斗,通过分液漏斗可以随时添加液体药品,通过分液漏斗还可以控制酸液的滴加速率,从而达到控制反应速率的作用,因此利用C装置制取CO2的优点是:可以随时添加液体药品,可以通过控制酸液的滴加速率达到控制反应速率的作用。
(2)①实验过程中,观察到烧瓶乙中有白色沉淀生成。烧瓶乙中注入的是饱和石灰水,二氧化碳和其反应生成碳酸钙和水,反应的化学方程式是:CO2+Ca(OH)2=CaCO3↓+H2O。
②曲线1表示的是水加入二氧化碳气体中压强的变化,二氧化碳能溶于水,瓶内压强减小,因此BC段气压逐渐变小的原因是:CO2溶于水;振荡增大了二氧化碳气体和水的接触面积,使溶解更充分,溶解速度加快,瓶内压强减小就加快,因此导致CD段气压快速变小的操作是:振荡。
③不管是曲线1还是曲线3,开始一段瓶内压强增大是气体中加入液体短时间内体积增大造成的。经过短暂的压强增大后,瓶内压强都逐渐变小。曲线1表示的是水注入二氧化碳气体中,瓶内的压强减小,说明二氧化碳能溶于水,当然,二氧化碳在溶于水时有没有和水反应生成碳酸,实验中不能得出结论,需要补充一个证明碳酸的实验。通常情况下一体积水中只能溶解一体积二氧化碳,如果氢氧化钠不跟二氧化碳反应,只是二氧化碳溶于氢氧化钠溶液中的水,瓶内压强减小应该跟曲线1相似,而实验中曲线3注入二氧化碳中瓶内压强减小幅度远大于曲线1,说明二氧化碳除了溶于水,还跟氢氧化钠反应。因此对比曲线1与曲线3,能得出的结论是:ac。
【点睛】
本题的难点是对比曲线1与曲线3,能得出的结论,从两条曲线反应的压强变化上,只能得出瓶内二氧化碳气体减少和各自减少的幅度,可以比较得出氢氧化钠能跟二氧化碳反应,从曲线1的变化也可以得出二氧化碳能溶于水,至于二氧化碳能不能和水反应,需要补充证明有碳酸生成的实验。