氢氧化钠露置在空气中会与二氧化碳反应而变质
(提出问题)二氧化碳与氢氧化钠溶液反应没有明显现象,从哪些视角可以证明CO2与NaOH溶液发生了反应?
(作出猜想)猜想一:从生成物的视角;猜想二:从_________的视角;猜想三:从能量变化的视角……
(实验探究1)第一组同学分别取反应后的溶液少许于试管中,按如下四种方案实验:
A.滴加酚酞试液,若变红则说明没发生反应;
B.滴加BaCl2溶液,若有白色沉淀生成,则说明发生了反应;
C.滴加澄清石灰水,若有白色沉淀生成,则说明发生了化学反应;
D.滴加足量的稀盐酸,若产生能使澄清石灰水变浑浊的气体,则说明发生了反应。
①该小组同学通过讨论,一致认为_____方案是不正确的,原因是_____。
②若方案B正确,请写出此方案涉及的化学反应方程式_____。
(实验探究2)第二组同学利用压强传感器和CO2传感器设计了如图甲、乙两个实验装置,并进行实验,得到了压强随时间变化的曲线(如图丙)

①设计图乙实验的目的是_______________________________________________________。
②图丙中曲线______(填I或者II)表示CO2和NaOH溶液的反应。

(实验探究3)化学反应常常伴随着能量的变化,第三组同学利用温度传感器获得了实验过程中温度随时间变化的曲线(如图丁),曲线Ⅲ为CO2与NaOH溶液的反应,曲线IV为CO2与水的反应。由此证明CO2与NaOH反应是_____反应(填:“吸热”、“放热”)
(拓展延伸)查阅资料,Na2CO3溶液与CO2也会发生反应:Na2CO3+CO2+H2O==2NaHCO3
当10g8%的NaOH溶液通入一定体积的CO2后,所得溶液中的溶质是Na2CO3和NaHCO3,则参加反应的CO2的体积范围_____(该状况下,CO2的密度为2g/L)
(实验探究4)第四组同学对二氧化碳的性质再探究。实验步骤如下:
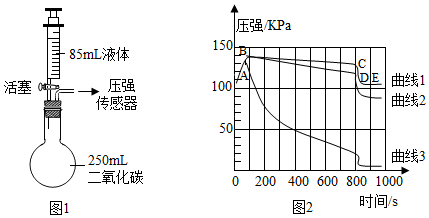
(1)图1所示装置的气密性良好,三个250mL的烧瓶内收集满CO2气体,三个注射器内各装有85mL的液体(分别是水、饱和石灰水、40%的氢氧化钠溶液)。连接好装置和压强传感器。
(2)三位同学同时迅速将注射器内85mL的液体(水、饱和石灰水、40%的氢氧化钠溶液)注入各自烧瓶中,关闭活塞。
(3)一段时间后,三位同学同时振荡烧瓶。观察烧瓶内气压随时间变化的曲线(如图2)
①导致曲线1中CD段气压急速减小的操作是___________。在不改变装置和药品的情况下,进一步降低E点的方法是_________。
②曲线2中发生的反应方程式为______________________________。
③曲线2与曲线3差异较大的原因是__________。
④对比曲线1、2、3,不能得出的结论是__________(填序号)。
A.CO2能与水发生反应
B.1体积水约溶解1体积CO2;
C.CO2能与NaOH溶液发生反应
D.检验CO2用饱和澄清石灰水较合适
E.吸收CO2用NaOH溶液较合适
答案
反应物 A NaOH溶液与CO2反应生成的Na2CO3溶液也显碱性,也能使酚酞试液变红,无法证明NaOH消失 BaCl2+Na2CO3=BaCO3↓+2NaCl 作对照,排除水对实验的干扰 Ⅱ 放热 0.22L< V <0.44L 振荡烧瓶 使烧瓶中气体进一步降温 Ca(OH)2+CO2=CaCO3↓+H2O Ca(OH)2溶解度小,饱和石灰水中Ca(OH)2的浓度明显小于40%NaOH溶液中NaOH的浓度,影响了CO2的吸收 AD
【详解】
【作出猜想】根据从反应物的角度分析解答;【实验探究1】①根据碳酸钠溶液显碱性能使酚酞溶液变红;②根据氯化钡溶液与碳酸钠溶液反应生成碳酸钡和氯化钠解答;【实验探究2】①根据对比实验分析解答;根据二氧化碳与氢氧化钠溶液反应压强降低解答;【实验探究3】根据图中信息解答;【拓展延伸】根据反应的化学方程式分析解答;【实验探究4】(3) ①根据题中信息分析解答;②根据水、饱和石灰水、40%的氢氧化钠溶液吸收二氧化碳的能力分析解答;③根据氢氧化钙的溶解度较小分析解答;④根据图中压强的变化分析解答。【作出猜想】猜想二:从反应物的视角;【实验探究1】①该小组同学通过讨论,一致认为A方案是不正确的,原因是NaOH溶液与CO2反应生成的Na2CO3溶液也显碱性,也能使酚酞试液变红,无法证明NaOH消失;②氯化钡溶液与碳酸钠溶液反应生成碳酸钡和氯化钠,反应的化学方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl;【实验探究2】①设计图乙实验的目的是作对照,排除水对实验的干扰;②二氧化碳与氢氧化钠溶液反应压强降低,故图丙中曲线Ⅱ表示CO2和NaOH溶液的反应;【实验探究3】由题中信息可知曲线Ⅲ为CO2与NaOH溶液的反应,由曲线Ⅲ可知,二氧化碳与氢氧化钠反应后温度升高,由此证明CO2与NaOH反应是放热反应;【拓展延伸】分析两步反应的方程式:2NaOH+CO2= Na2CO3+H2O、 Na2CO3+ H2O + CO2=2 NaHCO3,每0.8gNaOH消耗0.44g CO2可恰好完全反应生成Na2CO3,若又有0.44gCO2可恰好完全反应生成NaHCO3。由于最终得到的溶液中同时存在Na2CO3和NaHCO3,可得CO2的质量介于0.44g~0.88g之间,除以密度即可得体积范围为0.22L< V <0.44L;【实验探究4】(3) ①个烧瓶中的压强,都是先急剧增大(这是由于液体突然加入,装置内气体迅速被压缩),随后逐渐减小(由于CO2气体逐渐被液体吸收)。对于CD段,气压迅速下降,说明某操作加速了气体被吸收的速率,考虑反应速率的影响因素和题目提示,这种操作极有可能为振荡烧瓶,增大气体和液体之间的接触面积;由图中可以看出,E点与D点基本相平,不改变装置和药品,要使E进一步降低,可以考虑气体压强的其他影响因素,也就是温度,因此可以降低烧瓶内气体的温度;②水、饱和石灰水、40%的氢氧化钠溶液吸收二氧化碳的能力依次增强。故曲线2表示二氧化碳与氢氧化钙溶液的反应,反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;③曲线2与曲线3差异较大的原因是Ca(OH)2溶解度小,饱和石灰水中Ca(OH)2的浓度明显小于40%NaOH溶液中NaOH的浓度,影响了CO2的吸收;④A、通过实验只能得出,水可以吸收一定量CO2,但由于没有探究新物质生成,无法证明究竟是二氧化碳溶于水还是与水反应,错误;B、加入了85mL水,最终气压与开始时基本没有改变,说明大约有85mLCO2被吸收,正确;C、将水与NaOH的图像对比可知,NaOH溶液吸收CO2的能力明显强于水,所以证明二者可以发生反应,正确;D、本实验并没有关注石灰水与CO2反应的现象,也就不能说明是否可用饱和澄清石灰水检验CO2,错误;E、由曲线③可知,氢氧化钠溶液吸收二氧化碳的能力较强,故吸收CO2用NaOH溶液较合适,正确。故选AD。

 CO2是碳充分燃烧的化学方程式。
CO2是碳充分燃烧的化学方程式。  2H2↑+O2↑为例加以说明。
2H2↑+O2↑为例加以说明。 