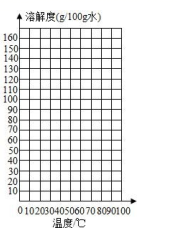
下表是硝酸钾在不同温度时的溶解度(单位:g/100g水)
| 温度 | 1 | 20 | 40 | 60 | 70 | 80 |
| S(KNO3) | 13.3 | 31.6 | 63.9 | 110 | 100 | 169 |
①分析上述数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度是____℃;
请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线_______。
②60℃时,50g水中最多溶解_______gKNO3。
③除去KNO3晶体中混有的少量NaCl,通过:溶解、蒸发浓缩、_____、______、洗涤、干燥得到比较纯净的KNO3晶体。
④将硝酸钾的饱和溶液变为不饱和溶液,说法正确的是__________(选填编号)。
A.溶解度一定不变 B.溶剂质量一定增大
C.溶质质量一定不变 D.溶质质量分数一定减小
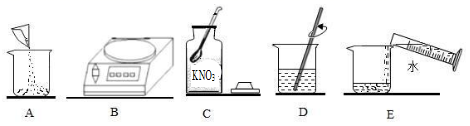
⑤20℃时,实验室配制一瓶最浓的硝酸钾溶液。在配制过程中操作顺序是______(填编号),溶质质量分数为______(精确0.1%),装瓶后贴上标签并写上_____。
⑥取上述⑤配制的20℃100g硝酸钾的饱和溶液(如A烧杯)进行如下操作,请回答:
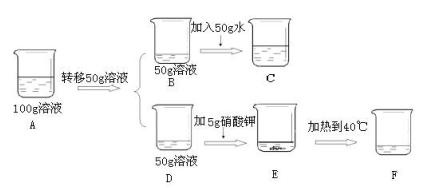
上述溶液中一定是不饱和溶液的是_____(填“A、B、C、D、E、F”),所含溶质的质量B___F(填“>”、“<”或“=”,下同),其中A、C、E、F溶液的溶质质量分数的大小关系是___。
答案
70  55 冷却结晶 过滤 C BCAED 24.0% KNO3溶液 24.0% CF < F>A=E>C
55 冷却结晶 过滤 C BCAED 24.0% KNO3溶液 24.0% CF < F>A=E>C
【详解】
由图表中数据可知硝酸钾的溶解度随温度的升高而增大,但到了70℃,溶解度反而降低,所以该温度时的溶解度有较大的误差;利用表中硝酸钾在不同温度下溶解度的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线如下图: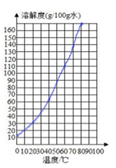
②由表中数据可知,60℃时硝酸钾的溶解度为110g,故50g水中最多溶解55gKNO3
③除去KNO3固体中混有的少量NaCl,根据硝酸钾的溶解度随温度变化加大的特点,故提纯的步骤是:溶解、蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
④A、升高温度,硝酸钾的饱和溶液变为不饱和溶液,溶解度增大,选项错误;
B、升高温度,硝酸钾的饱和溶液变为不饱和溶液,溶剂质量不变,选项错误;
C、将硝酸钾的饱和溶液变为不饱和溶液,无论是升高温度,还是增加溶剂的质量,硝酸钾的质量始终不改变,选项正确;
D、升高温度,硝酸钾的饱和溶液变为不饱和溶液,溶质质量分数不变,选项错误。故选C;
⑤实验室用硝酸钾固体配制一定溶质质量分数的溶液,应先称量,再溶解,步骤为:BCAED;20℃时硝酸钾的溶解度为31.6g。故配制一瓶20℃时最浓的硝酸钾溶液,溶质质量分数=![]() %≈24%;装瓶后贴上标签并写上名称(KNO3溶液)和溶质质量分数(24%);
%≈24%;装瓶后贴上标签并写上名称(KNO3溶液)和溶质质量分数(24%);
⑥50g饱和硝酸钾溶液B(此时溶液中溶质质量为15.8g)加50g水得到溶液C,溶液C是不饱和溶液;50g饱和硝酸钾溶液D加5g硝酸钾得到E,E中有未溶解的硝酸钾固体,属于饱和溶液,E加热得到40℃,得到F(此时溶液中溶质的质量为15.8g+5g=20.8g),40℃时硝酸钾的溶解度为63.9g,那么50g水中最多溶解31.95g硝酸钾,此时F属于不饱和溶液。故填:CF;所含溶质的质量B<F;由溶液具有均一性可知,ABD溶质质量分数相等,又是20时的饱和溶液,故DE溶质质量分数相等,因此溶质质量分数A=B=D=E。由E加热到40℃得到F,F中溶剂质量不变,溶质质量增加,故溶质质量分数F>E;由B加50g水得到C,C中溶剂质量增加,溶质质量分数C<B。故A、C、E、F溶液的溶质质量分数的大小关系是:F>A=E>C。