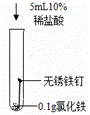
钢铁的腐蚀是重要研究课题。
(知识回顾)用如图所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。
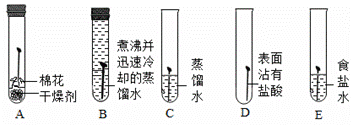
(1)由A、B、C的现象可知,铁的锈蚀是铁跟________________(填化学式)等物质作用的过程。
(2)试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是________________。
(实验探究)向试管D中(含生锈铁钉)加人过量10%稀盐酸,浸泡。可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。
(3)写出铁锈溶于盐酸的化学方程式:________________。
(4)推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。现进行如下3个实验(持续10小时,已知氢气不影响该反应)。
| 序号 | 实验I | 实验Ⅱ | 实验Ⅲ |
| 实验内容 |
|
|
|
| 现象 | 溶液颜色始终呈黄色 | 产生红褐色沉淀 | 溶液逐渐由黄色变浅绿色 |
①设计实验I的目的是________________。
②综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是__________。
(拓展延仲)研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到如下资料。
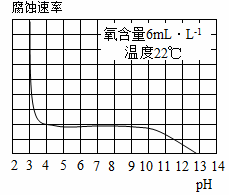
(5)如图表示水样温度22℃、氧含量6mL·L-1时,钢铁腐蚀速率与水样pH的关系。当pH<4时,钢铁腐蚀速率明显增大的原因是___________________。
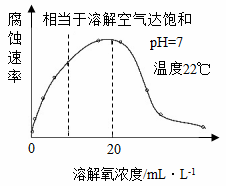
(6)如图表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超过20mL·L-1时,钢铁腐蚀速率明显下降的原因可能是________________。
答案
O2、H2O 除去蒸馏水中溶解的氧气且防止氧气再溶于水 ![]() 探究FeCl3能否与盐酸反应生成FeCl2 酸性条件下,FeCl3与铁钉发生反应生成FeCl2 钢铁与水样中的H+发生反应 钢铁表面生成较致密的氧化膜,阻碍O2、H2O与钢铁的接触
探究FeCl3能否与盐酸反应生成FeCl2 酸性条件下,FeCl3与铁钉发生反应生成FeCl2 钢铁与水样中的H+发生反应 钢铁表面生成较致密的氧化膜,阻碍O2、H2O与钢铁的接触
【解析】
【分析】
【详解】
(1)干燥试管A和不含氧气的试管B中铁钉几乎没有生锈,而装有蒸馏水的试管C中铁钉明显锈蚀,所以铁的锈蚀是铁跟水和氧气有关,化学式为O2、H2O;
(2)试管B和试管C做对比,由控制变量法,试管C还有氧气,而是管B不含氧气,因此,试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是除去蒸馏水中溶解的氧气且防止氧气再溶于水。
(3)铁锈溶于盐酸的化学方程式![]() ;
;
(4)根据题意,我们推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。首先我们要看是不是FeCl3与盐酸反应生成FeCl2从而使溶液变为浅绿色,因此①设计实验I的目的是探究FeCl3能否与盐酸反应生成FeCl2。实验Ⅰ盐酸溶液中FeCl3溶液仍然呈现黄色,说明不是FeCl3与盐酸反应生成FeCl2从而使溶液变为浅绿色;实验Ⅱ在水中(中性环境)下,FeCl3与铁钉不能发生反应生成FeCl2;实验Ⅲ酸性条件下,FeCl3与铁钉发生反应生成FeCl2,因此综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是酸性条件下,FeCl3与铁钉发生反应生成FeCl2。
(5)当pH<4时溶液中存在游离的H+,因此钢铁腐蚀速率明显增大的原因是钢铁与水样中的H+发生反应促进钢铁腐蚀。
(6)当溶解氧超过20mL·L-1时氧气与钢铁反应生成致密的氧化膜从而阻止钢铁腐蚀速率,因此钢铁腐蚀速率明显下降的原因可能是钢铁表面生成较致密的氧化膜,阻碍O2、H2O与钢铁的接触。