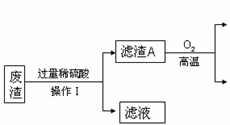
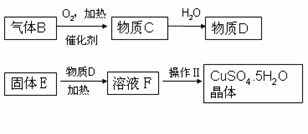
(2020·广饶期末)某炼铁废渣中含有大量CuS及少量的铁和铁的化合物(主要是氧化铁),工业上以该废渣为原料生产CuSO4•5H2O晶体的流程如图:
参考资料:CuS常温下和稀酸不发生反应。
(1)操作I的名称为________,该过程中玻璃棒的作用是________,由操作I得到的滤液中含有的溶质为________。写出滤渣A和氧气反应的化学方程式________。
(2)由固体E得到溶液F的过程通常需要加热,其作用是________,写出该步反应化学方程式:________。
(3)操作Ⅱ包括的步骤有加热浓缩、________、过滤。上述过程中可以循环利用的物质是________。
答案
(1)过滤;引流;硫酸亚铁、硫酸铁、硫酸;2CuS+3O2 ![]() 2CuO+2SO2
2CuO+2SO2
(2)加快反应速率;CuO+H2SO4 ![]() CuSO4+H2O
CuSO4+H2O
(3)降温结晶;硫酸
【解析】(1)操作I的名称为过滤,该过程中玻璃棒的作用是引流,由操作I得到的滤液中含有的溶质为铁、氧化铁分别和硫酸反应生成的硫酸亚铁、硫酸铁,还有过量的硫酸;滤渣A是硫化铜,和氧气在高温条件下反应生成氧化铜和二氧化硫,反应的化学方程式:2CuS+3O2 ![]() 2CuO+2SO2;(2)由固体E得到溶液F的过程通常需要加热,其作用是加快反应速率;该步反应化学方程式 CuO+H2SO4
2CuO+2SO2;(2)由固体E得到溶液F的过程通常需要加热,其作用是加快反应速率;该步反应化学方程式 CuO+H2SO4 ![]() CuSO4+H2O;(3)操作Ⅱ包括的步骤有加热浓缩、降温结晶、过滤,上述过程中可以循环利用的物质是D(硫酸)。
CuSO4+H2O;(3)操作Ⅱ包括的步骤有加热浓缩、降温结晶、过滤,上述过程中可以循环利用的物质是D(硫酸)。
【分析】解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。