实验室常用甲酸(H2CO2)和浓硫酸混合加热制备一氧化碳,反应的化学方程式为H2CO2![]() H2O+CO↑,再用一氧化碳还原氧化铜,反应方程式为CO+CuO
H2O+CO↑,再用一氧化碳还原氧化铜,反应方程式为CO+CuO![]() Cu+CO2,实验装置如图所示。请回答:
Cu+CO2,实验装置如图所示。请回答:
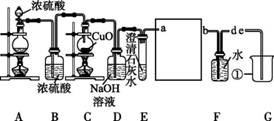
(1)装置G中①仪器的名称是 ,装置B的作用是 。
(2)装置E是用来检验装置D吸收二氧化碳是否完全,该装置 (填“能”或“不能”)达到目的;写出D中的化学方程式: 。
(3)为避免一氧化碳污染空气,回收利用一氧化碳,方框中应连接装置F和G,导管接口的顺序为a→ → _________→e。
(4)反应过程中,装置C的烧瓶内氧化铜粉末处于“沸腾”状态(一氧化碳气流冲击所致),这样有利于 ,烧瓶内固体物质的颜色变化: 。
(5)请你设计一个探究氧化铜是否反应完全的实验:_________________________ __________。
答案
(1)烧杯 除去一氧化碳中的水蒸气
(2)不能 2NaOH+CO2![]() Na2CO3+H2O
Na2CO3+H2O
(3)d b
(4)增大一氧化碳与氧化铜的接触面积 黑色变为红色
(5)取少量反应后的固体样品于试管中,加入适量的稀硫酸(加热),振荡,观察溶液颜色
解析: (1)装置G中①仪器的名称是烧杯;浓硫酸具有吸水性,因此,装置B中的浓硫酸可以除去生成的一氧化碳气体中的水蒸气。(2)该装置不能达到实验目的,因为通入二氧化碳气体的导管没有插入澄清石灰水中,二氧化碳没有与澄清石灰水充分接触,反应不能发生;D中是二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,反应的化学方程式为2NaOH+CO2![]() Na2CO3+H2O。(3)回收的一氧化碳应储存在装置F中,进入装置F中的一氧化碳气体将水排入装置G中,因此,导管接口的顺序为:a接d,b接e。(4)“沸腾”的氧化铜粉末与一氧化碳的接触面积增大,使反应进行得更快、更完全;黑色的氧化铜粉末被一氧化碳还原成红色的金属铜,所以,烧瓶内固体物质的颜色变化是黑色变为红色。(5)铜与稀硫酸不反应,氧化铜能与稀硫酸反应生成硫酸铜和水,因此,要证明氧化铜是否完全反应的实验方案是取少量反应后的固体样品于试管中,加入适量的稀硫酸并加热,振荡试管,如观察到固体部分溶解,溶液由无色变为蓝色,证明氧化铜未完全反应,如无现象,证明氧化铜已完全反应。
Na2CO3+H2O。(3)回收的一氧化碳应储存在装置F中,进入装置F中的一氧化碳气体将水排入装置G中,因此,导管接口的顺序为:a接d,b接e。(4)“沸腾”的氧化铜粉末与一氧化碳的接触面积增大,使反应进行得更快、更完全;黑色的氧化铜粉末被一氧化碳还原成红色的金属铜,所以,烧瓶内固体物质的颜色变化是黑色变为红色。(5)铜与稀硫酸不反应,氧化铜能与稀硫酸反应生成硫酸铜和水,因此,要证明氧化铜是否完全反应的实验方案是取少量反应后的固体样品于试管中,加入适量的稀硫酸并加热,振荡试管,如观察到固体部分溶解,溶液由无色变为蓝色,证明氧化铜未完全反应,如无现象,证明氧化铜已完全反应。

 2Fe + 3CO2
2Fe + 3CO2 