请分析下列实验装置,阅读所给材料,回答问题:
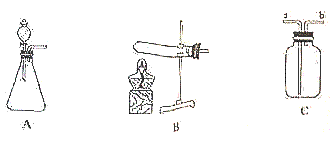
材料:氨气(NH3)常温下是一种具有刺激性气味的无色气体,对人体有较大毒性,密度比空气小,极易溶于水,其水溶液显碱性。实验室可用加热氯化铵(NH4Cl)和熟石灰两种固体的方法制取氯气,同时生成氯化钙和水。铵盐易溶于水,Ca(OH)2微溶于水,CaCl2溶液显中性,NH4Cl溶液显酸性。
(1)实验室制取氨气的化学方程式为 ,应选取的发生装置是 (填装置编号)。
(2)用C装置收集氨气时,气体应从 口通入(填“a”或“b”);检验氨气可用湿润的 石蕊试纸(填“红色”或“蓝色”)。
(3)某同学对充分反应后反应器内的固体物质做进一步研究:
【提出问题】固体物质的成分是什么?
【作出猜想】猜想I:Ca(OH)2、NH4Cl和CaCl2
猜想II:Ca(OH)2和CaCl2
猜想III:NH4Cl和CaCl2
猜想IV:只有CaCl2
有同学对上述猜想提出质疑:有一种猜想不合理。你认为是 。
【实验探究】①取反应器内少量固体于试管中,加水溶解、过滤,得到滤液。
②取少量溶液于试管中,滴加无色酚酞试液溶液,颜色无变化,说明 (填一种猜想)不正确。
③再取少量滤液于另一试管中,滴加AgNO3溶液,产生白色沉淀,该同学认为固体中含有NH4Cl,于是得出结论猜想III正确。你认为该同学的结论 (填“合理“或“不合理”),理由是 。
【评价反思】该同学认为实验装置仍有不足之处,请你提出改进措施: 。
答案
答案(1)2NH4Cl+Ca(OH)2△CaCl2+2H2O+2NH3↑;B
(2)b;红色
(3)【作出猜想】猜想I
【实验探究】②猜想II③不合理;氯化钙也能和硝酸银反应生成白色沉淀
【评价反思】在C装置的a导管连接吸收氨气的装置
解析(1)实验室制取氨气的化学方程式为2NH4Cl+Ca(OH)2△CaCl2+2H2O+2NH3↑,反应需要加热,应选取的发生装置是B。
(2)用C装置收集氨气时,由于氨气密度比空气小,气体应从b口通入;
检验氨气可用湿润的红色石蕊试纸,这是因为氨气能够水反应生成氨水,氨水能使湿润的红色石蕊试纸。
(3)【作出猜想】上述猜想中,猜想I不合理,这是因为氢氧化钙和氯化铵不能共存。
【实验探究】②取少量溶液于试管中,滴加无色酚酞试液溶液,颜色无变化,说明溶液不显碱性,即溶液中不含有氢氧化钙,说明猜想II不正确。
③该同学的结论不合理,理由是氯化钙也能和硝酸银反应生成白色沉淀。
【评价反思】该同学认为实验装置仍有不足之处,不足之处是没有处理尾气装置,改进措施是在C装置的a导管连接吸收氨气的装置。

 Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑