氯碱工业以粗盐(主要成分是NaCl,含少量泥沙、CaCl2、MgCl2)为原料,生产氯气和氢氧化钠,模拟流程如图: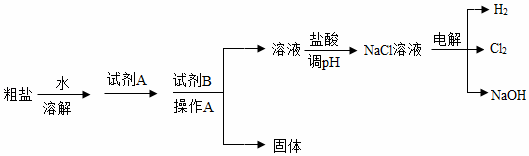
(1)试剂A与试剂B的组合为 (填序号)
①KOH ②NaOH ③K2CO3 ④Na2CO3
(2)操作A需使用玻璃棒,玻璃棒的作用是 。
(3)流程中Mg元素必须转化成 (填化学式)才能完全除去。
(4)写出电解NaCl溶液的化学方程式 。
(5)该工业副产品H2目前还不能作为燃料被广泛应用,其理由 (答一条即可)。
答案
【分析】氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
玻璃棒用途:引流、搅拌、转移物质等;
电解饱和食盐水生成氢氧化钠、氯气和氢气。
【解答】解:(1)试剂A与试剂B的组合为氢氧化钠、碳酸钠,分别除去氯化镁、氯化钙。
故填:②④。
(2)操作A(过滤)需使用玻璃棒,玻璃棒的作用是引流。
故填:引流。
(3)流程中Mg元素必须转化为Mg(OH)2才能完全除去。
故填:Mg(OH)2。
(4)电解NaCl溶液生成氢氧化钠、氯气和氢气,反应的化学方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
故填:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(5)该工业副产品H2目前还不能作为燃料被广泛应用,其理由是不易储存、不安全、制取价格较高等。
故填:不易储存。
【点评】合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础。
