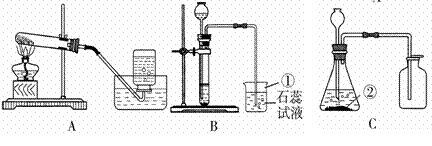
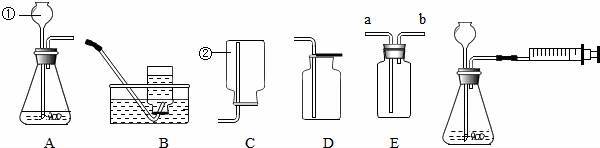
图A﹣E是化学实验中常用的几种装置.

请回答下列问题:
(1)指出有编号的仪器名称:① ,② .
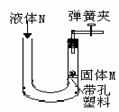
(2)可用推拉注射器活塞的方法检查A装置的气密性(图F).当缓慢向右拉活塞时,如果装置气密性良好,可观察到
A.长颈漏斗下端口产生气泡
B.瓶中液面明显上升
C.长颈漏斗内有液面上升
D.注射器内有液体
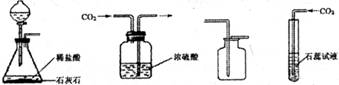
(3)利用上述A、D装置的组合可以制取的一种气体是 ,写出实验室制取该气体的化学反应方程式 .
(4)请你设计实验证明自己所选择的这种气体.
实验操作: 向
实验现象: 实验结论: (5)若用E装置对你选气体进行干燥,可在瓶内装 ;进气管应该连接在 (填字母)
答案
【分析】(1)据常用仪器回答;
(2)根据检查装置气密性的原理分析即可.装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(3)A装置适用于固体和液体常温制取气体,D装置收集密度比空气大的气体,所以该套装置可用于二氧化碳或氧气的制取,据反应原理书写方程式;
(4)检验二氧化碳用澄清的石灰水;
(5)浓硫酸具有吸水性,可用来干燥二氧化碳,二氧化碳密度比空气大,应从长导管进入,与浓硫酸充分接触.
【解答】解:(1)编号仪器分别是长颈漏斗和集气瓶;
(2)向外拉活塞时,若装置不漏气,锥形瓶中气体压强减小,外界大气压迫使外边的空气通过长颈漏斗进入锥形瓶,从而观察到长颈漏斗下端口有气泡冒出;
(3)A装置适用于固体和液体常温制取气体,D装置收集密度比空气大的气体,所以该套装置可用于二氧化碳或氧气的制取(用过氧化氢溶液和二氧化锰常温混合分解),方程式分别是:CaCO3+2HCl═CaCl2+H2 O+CO2↑、2H2O2![]()
![]() 2H2O+02↑;
2H2O+02↑;
(4)检验二氧化碳用澄清的石灰水,若澄清的石灰水变浑浊则是二氧化碳;
(5)浓硫酸具有吸水性,可用来干燥二氧化碳,二氧化碳密度比空气大,应从长导管进入,与浓硫酸充分接触;
故答案为:(1)长颈漏斗;集气瓶;
(2)A;
(3)二氧化碳(或氧气);CaCO3+2HCl═CaCl2+H2 O+CO2↑(或2H2O2![]()
![]() 2H2O+02↑);
2H2O+02↑);
(4)向集气瓶内倒入澄清的石灰水;澄清的石灰水变浑浊;气体是二氧化碳;
(5)浓硫酸;a.
【点评】了解气体的干燥和净化;掌握二氧化碳、氧气的制取和检验方法;正确书写化学方程式.