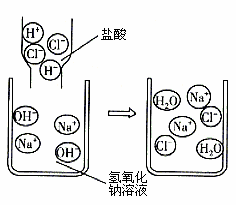
某兴趣小组同学为了探究干电池中物质的成分,将电池剖开时闻到异味且发现有黑色物质。
【提出问题】为什么有异味?黑色物质的成分是什么?
【网络搜索】干电池的成分有二氧化锰、铁粉及铵盐等物质。
【实验设计】同学们分别设计实验进行探究。
实验Ⅰ.小婧取适量黑色物质与__________混合置于研钵内研磨,嗅到氨味,再用湿润的石蕊试纸检测,试纸变蓝,证明黑色物质中含有铵盐。
实验Ⅱ.小清用一种物理方法发现黑色物质中不含铁粉。他采用的方法是______________。
实验Ⅲ.小明将黑色物质加入适量的水中搅拌,静置后过滤,取滤渣进行实验。

上述实验中产生氧气的化学方程式为______________________________,据此小明认为黑色物质中一定含有二氧化锰。
【交流讨论】大家对小明的结论提出了质疑。
(1)小莹认为若要证明黑色物质中一定含有二氧化锰,必须验证二氧化锰的质量和____________在反应前后都没有发生变化。
(2)小仪认为除了小莹考虑的因素外,另一个原因是氧化铜等黑色物质对过氧化氢分解也有催化作用。
【结论与反思】(1)干电池中一定含有铵盐,可能含有二氧化锰,一定不含有铁粉。
(2)面对网络信息,我们要去伪存真,不应盲从。
答案
【实验设计】实验Ⅰ.熟石灰 实验Ⅱ.用磁铁吸引 实验Ⅲ.有气泡产生 伸入带火星的木条 2H2O2![]() 2H2O+O2↑ 【交流讨论】(1)化学性质
2H2O+O2↑ 【交流讨论】(1)化学性质

 Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑