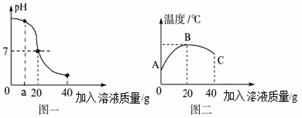
 某校化学小组在利用盐酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如下面图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。请回答下列问题:
某校化学小组在利用盐酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如下面图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。请回答下列问题:
⑴图一:该变化对应的实验操作是将 滴加到另一种溶液中。当滴入溶液的质量为ag时,溶液中的溶质为 (填化学式)。当溶液的pH=7时,溶液中的主要离子是 (填离子符号)。当加入溶液的质量为40g时,向所得溶液中滴加紫色石蕊试液,溶液呈 色。
⑵图二:表示酸碱恰好完全反应的点是____,说明该反应伴随_____现象(填“放热”或“吸热”)。
⑶如果实验中用去了20g溶质质量分数为4%的氢氧化钠溶液,根据图示计算稀盐酸中溶质的质量分数。
答案
(1) 盐酸。 NaCl和NaOH 。 Na+ 、Cl- 。 红。
(2) B , 放热
(3)(5分)解:设稀盐酸中溶质的质量为X
NaOH + HCl = NaCl + H2O
40 36.5
20g×4 % X
40/20g×4 % = 36.5/X
X = 0.73g
稀盐酸中溶质的质量分数为0.73g/20g = 3.65 %
答:稀盐酸中溶质的质量分数为3.65 % 。