某实验小组利用废硫酸液制备K2SO4,设计的流程如图所示:
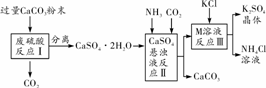
(1)反应Ⅰ中加入粉末状CaCO3的原因______________________。
(2)图中反应Ⅱ、Ⅲ后的操作名称是________;其中玻璃棒的用途是________________。
(3)反应Ⅲ中相关物质的溶解度如下表所示:
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
则反应Ⅲ的化学方程式为__________________________________________;常温下该反应能发生的原因是________________________________________________________。
(4)写出K2SO4在农业上的一点用途____________________________。
答案
(1)增大碳酸钙与硫酸的接触面积,使反应更快更充分
(2)过滤 引流 (3)2KCl+(NH4)2SO4=== K2SO4↓+2NH4Cl 由于相同的温度下硫酸钾的溶解度较氯化钾和硫酸铵的都小,所以氯化钾和硫酸铵在溶液中相互交换离子生成硫酸钾沉淀,使溶液中钾离子和硫酸根离子的浓度都显著减少,符合复分解反应的条件 (4)用作钾肥