有一包白色固体可能含有碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种.某化学兴趣小组为探究其成分做了以下实验:
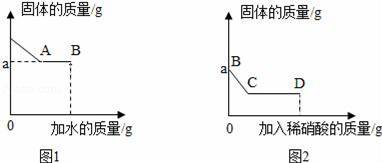
Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图1所示;
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色;
Ⅲ.继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示.

请回答下列问题:
(1)写出一个步骤1中反生反应的化学方程式 ;
(2)BC段可观察到的现象是 ,从C到D液体的pH (填“增大”、“减小”或“不变”);
(3)原白色固体中一定含有 ,可能含有 ;
(4)D点时,溶液中一定含有的溶质是 .
答案
【考点】物质的鉴别、推断;碱的化学性质;溶液的酸碱性与pH值的关系;盐的化学性质;书写化学方程式.
【专题】混合物组成的推断题.
【分析】根据碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠都是可溶于水的物质,由图1可知,加入水,有不溶物,说明了上述物质间发生反应生成了沉淀,由于碳酸钠、硫酸钠都能与硝酸钡反应生成沉淀,由此可知,一定存在硝酸钡;由图2可知沉淀加入稀硝酸沉淀部分溶解,沉淀应为碳酸钡和硫酸钡的混合物,说明了原混合物中一定有碳酸钠和硫酸钠.由取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色,说明了不含有氢氧化钠进行分析.
【解答】解:由图1可知,加入水,有不溶物,说明了上述物质间发生反应生成了沉淀,由于碳酸钠、硫酸钠都能与硝酸钡反应生成沉淀,由此可知,一定存在硝酸钡;由图2可知沉淀加入稀硝酸后,沉淀部分溶解,沉淀应为碳酸钡和硫酸钡的混合物,说明了原混合物中一定有碳酸钠和硫酸钠;由取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色,说明了不含有氢氧化钠.
(1)碳酸钠和硝酸钡发生复分解反应生成碳酸钡沉淀和硝酸钠,化学方程式为:Na2CO3+Ba(NO3)2=BaCO3↓+2NaNO3;
(2)由上述分析可知,BC段可观察到的现象是固体部分溶解,有气泡冒出,从C到D液体的酸性增强,液体的pH减小;
(3)由上述分析可知,原白色固体中一定含有碳酸钠、硫酸钠、硝酸钡,可能含有氯化钾;
(4)D点时,溶液中一定含有的溶质是硝酸钠、硝酸钡、硝酸.
故答案为:(1)Na2CO3+Ba(NO3)2=BaCO3↓+2NaNO3;
(2)固体部分溶解,有气泡冒出;减小;
(3)碳酸钠、硫酸钠、硝酸钡;氯化钾;
(4)硝酸钠、硝酸钡、硝酸.
【点评】在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.