化学小组为探究铁、铜、锌、银的金属活动性顺序,设计了如图所示的三个实验(其中金属均已打磨,其形状、大小及同种稀盐酸的用量均相同)。
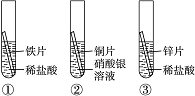
(1)小强同学认为通过实验①和③可以比较铁和锌的金属活动性,他依据的实验现象是________________________________________________________________________。
(2)一段时间后,观察到实验②的铜片表面有银白色固体附着,这说明铜比银的活动性________(填“强”或“弱”)。该反应的化学方程式为____________________________。
(3)小华、小红两位同学认为上述实验方案不足以得出四种金属的活动性顺序,并在上述实验的基础上,利用金属不同的化学性质分别补充了一个实验(如图所示),都实现了探究目的。小华同学的实验:x是金属______,y是______溶液;小红同学的实验:x是金属______,y是______![]() __溶液。
__溶液。
![]()
答案
解析:(1)铁和锌都能与稀盐酸反应产生氢气,但锌与稀盐酸反应的速率明显快于铁,故可通过观察产生气泡的速率快慢判断锌的活动性强于铁。(2)铜能从硝酸银溶液中置换出银,说明铜的活动性强于银。(3)通过三个实验可以证明锌的活动性强于铁,铜的活动性强于银,但无法判断铁与铜的活动性强弱。可将铁丝插入硫酸铜溶液中,通过铁能从硫酸铜溶液中置换出铜,得出铁的活动性强于铜的结论;也可将铜丝插入稀盐酸中,根据两者不能反应,证明铜在金属活动顺序表中排在H后,也就得出了活动性铁强于铜的结论。
答案:(1)锌与稀盐酸反应产生气泡的速率比铁快
(2)强 Cu+2AgNO3===Cu(NO3)2+2Ag
(3)铁(或Fe) 硫酸铜(或CuSO4) 铜(或Cu) 稀盐酸(或HCl)(答案合理即可)

 Cu+H2O
Cu+H2O 2Fe+3H2O
2Fe+3H2O 2Cu+CO2↑
2Cu+CO2↑ 4Fe+3CO2↑
4Fe+3CO2↑