1.CO2是初中化学重点研究的气体之一。某化学兴趣小组设计了如下实验来探究CO2的制取和性质:
(1)该兴趣小组用干燥管、烧杯、铜网等设计装配了一个在实验室中制取二氧化碳气体的装置,如右图所示。在干燥管内的铜网上应盛放 ;若将铜网换成铁网,可能产生的后果是 ,其原因是(用化学方程式表示) 。

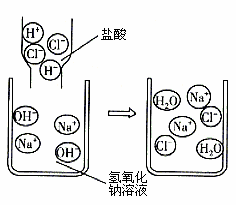
(2)该兴趣小组同学将制得的CO2分别通人澄清石灰水和氢氧化钠溶液中,他们观察到前者变浑浊,后者无明显现象。CO2和NaOH是否发生了化学反应?
①小明设计了甲、乙两个实验来验证C02与NaOH发生了化学反应,如右图所示。实验现象为:甲——软塑料瓶变瘪,乙——“瓶吞鸡蛋”。
小虎同学认为上述实验是可行的。其共同原理是
。
小雯同学提出质疑,她认为上述实验还不足以说明CO2和NaOH发生了反应。其理由是 。
小明同学针对小雯的质疑又补充了一个对照实验,这个实验是
。
②小虎向甲实验后变瘪塑料瓶的溶液中加入 ,观察到
现象,从而证明CO2与NaOH已经发生了反应。
答案
(1)大理石(或石灰石) 铁网被腐蚀,制得的CO2气体中混有H2 Fe+2HCl=FeCl2+H2↑
(2)①氢氧化钠溶液能与CO2发生反应,瓶内气压降低 CO2能溶于水,也能使瓶内气压降低 将氢氧化钠溶液换成等体积的水,做同样的实验,看现象是否有差别。 ②稀盐酸 有气泡产生(或加氯化钙溶液 有沉淀生成等)

 Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑