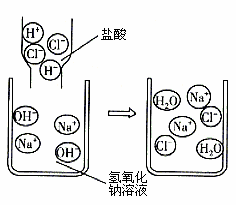
小明向氢氧化钠溶液中滴加了稀盐酸,发现没有明显现象。为了判断两者是否恰好完全反应,他取少量反应后的溶液加入试管中,滴加几滴无色酚酞溶液,振荡后观察到酚酞溶液不变色。
(1)根据上述现象,小明得出“两种物质恰好完全反应”的结论。小白认为小明的结论是不合理的,其理由是_____________________________________________________________
________________________________________________________________________。
(2)小白利用pH试纸测反应后溶液的pH,以确定两者是否恰好完全反应。请你选用其他试剂再设计一个实验,以验证氢氧化钠和盐酸是否恰好完全反应(要求写出选用的试剂、可能观察到的现象和相应的结论)_______________________________________________________
________________________________________________________________________。
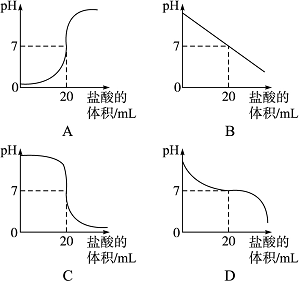
(3)小白为了继续探究“在氢氧化钠与盐酸反应的过程中,溶液的pH是如何变化的”这一问题,进行如下实验:在一定量的氢氧化钠溶液中逐渐滴加盐酸,用pH试纸测定溶液的pH,记录数据如下表:
| 盐酸的体 积/mL | 0 | 10 | 19.5 | 20 | 20.5 | 30 | 40 |
|
| 13 | 12 | 11 | 7 | 3 | 2 | 1 |
下图中能合理表示该反应过程中pH变化的图像是________。
答案
答案:(1)无色酚酞遇到酸也不变色
(2)CaCO3,如果出现气泡,那么盐酸过量,溶液显酸性,如果没有出现气泡则溶液![]() 显中性 (3)C
显中性 (3)C

 Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑