实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是( )
①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
A.①② B.①③ C.②④ D.③④
A
【解析】
①称量的氯化钠固体中含有不溶性杂质,导致氯化钠质量偏小,从而导致配制的氯化钠溶液溶质质量分数偏小,正确;②用量筒量取水时仰视读数,导致读数偏小,而量筒中水的体积偏大,最终导致配制的氯化钠溶液溶质质量分数偏小,正确;③往烧杯中加水时有水溅出,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,错误;④溶液具有均一性,将配制好的溶液往试剂瓶中转移时有少量溅出,溶质质量分数不变,错误。故选A。
欲配制10.0%的NaCI溶液50g,部分操作如下图所示,正确的是
A.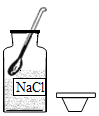 取固体 B.
取固体 B.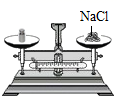 称固体
称固体
C.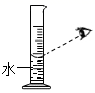 量取水 D.
量取水 D. 写标签
写标签
D
【解析】
A、取用固体粉末状药品时,瓶塞要倒放,应用药匙取用,图中瓶塞没有倒放,所示操作错误;B、托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,图中所示操作错误;C、量取液体时,视线与液体的凹液面最低处保持水平,图中俯视刻度,操作错误;D、标签中填上相应的内容是溶液的名称、溶质的质量分数,图中所示标签书写的内容是氯化钠溶液、10.0%,正确。故选D。
甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是
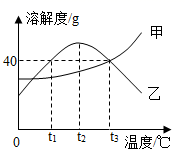
A.t1 ℃时,甲的溶解度大于乙的溶解度
B.t2 ℃时,乙的饱和溶液升温或降温均会析出晶体
C.乙溶液从t3 ℃降温到t1 ℃,乙溶液中的溶质质量分数会发生改变
D.t3 ℃时,50 g水中加入40 g的甲物质充分溶解可得到90 g甲的饱和溶液
B
【解析】
A、由溶解度曲线可知,t1℃时,乙的溶解度大于甲的溶解度,错误;B、t2℃时,乙的溶解度最大,故乙的饱和溶液升温或降温均会析出晶体,正确;C、乙溶液从t3℃降温到t1℃,其溶解度变大,那么不会有晶体析出,溶质的质量分数不变,错误;D、t3℃时,甲的溶解度为40g,即该温度时,40g甲溶解在100g水中恰好形成饱和溶液,那么t3℃时,50g水中加入40g的甲物质只能溶解20g甲,得到的溶液的质量为70g,错误。故选B。
下列关于溶液说法正确的是( )
A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液
B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制50gl6%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
D
【详解】
A、植物油难溶于水,将植物油放入水中,充分搅拌后不能形成溶液,故选项说法错误;B、溶液具有均一性,把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数均为20%,故选项说法错误;C、一种物质的饱和溶液还能溶解其它的溶质,向20°C时的蔗糖饱和溶液中加入食盐,食盐能继续溶解,故选项说法错误;D、配制50gl6%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、装瓶存放,故选项说法正确;故选D。
配制70克16%的 NaCl溶液,下列操作会使所配溶液溶质质量分数大于16%的是
A. 称取氯化钠 B.
称取氯化钠 B.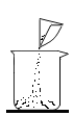 转移氯化钠
转移氯化钠
C.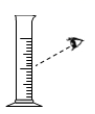 量取水 D.
量取水 D.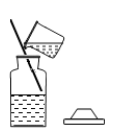 配好后装瓶
配好后装瓶
C
【详解】
A、用托盘天平称量氯化钠时,砝码和食盐放反了,溶质的质量=砝码质量-游码质量,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,故A错误;
B、转移氯化钠时,若出现洒落,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,故B错误;
C、用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故C正确;
D、配好后装瓶,溶液具有均一性,溶质质量分数不变,故D错误。故选C。
本卷还有95题,登录并加入会员即可免费使用哦~

该作品由: 用户胡阳光分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。