“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是![]()
![]()
![]() 比较硬度,硬度小的是“愚人金”
比较硬度,硬度小的是“愚人金”
![]() 灼烧,表面变色的是“愚人金”
灼烧,表面变色的是“愚人金”
![]() 浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
![]() 浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
D
【解析】
![]() 比较硬度,合金的硬度比纯金属的硬度大,故硬度小的是纯金,故错误;
比较硬度,合金的硬度比纯金属的硬度大,故硬度小的是纯金,故错误;
![]() 灼烧,铜能够和氧气反应产生氧化铜,表面变黑色的是“愚人金”,故正确;
灼烧,铜能够和氧气反应产生氧化铜,表面变黑色的是“愚人金”,故正确;
![]() 浸没在稀硫酸中,锌能够和稀硫酸反应产生氢气,因此表面有气泡产生的是“愚人金”,故正确;
浸没在稀硫酸中,锌能够和稀硫酸反应产生氢气,因此表面有气泡产生的是“愚人金”,故正确;
![]() 浸没在硫酸锌溶液中,三种金属都不能和硫酸锌反应,无法鉴别,故错误;
浸没在硫酸锌溶液中,三种金属都不能和硫酸锌反应,无法鉴别,故错误;
故选D。
在一定量的硝酸银和硝酸铜溶液中加入锌粉,充分反应后过滤,得到滤液和滤渣,下列分析正确的是( )
A.如果滤液显蓝色,则滤渣一定没有Cu
B.如果滤渣只含一种金属,滤液中的溶质可能含有三种
C.在滤渣中加入稀盐酸有气泡产生,滤液中的溶质可能含有两种
D.在滤渣中加入稀盐酸没有气泡产生,则滤渣一定含有Ag和Cu
B
【分析】
根据金属活动性顺序可知,三种金属的活动性顺序为:锌、铜、银,所以向硝酸银和硝酸铜的混合溶液中,加入一定量的锌粉,则锌能与硝酸银反应生成硝酸锌和银,能与硝酸铜反应生成硝酸锌和铜。
【详解】
A、如果滤液显蓝色,说明滤液中含有硫酸铜,金属锌可能没有和硫酸铜反应,也可能只和部分硫酸铜发生了反应,所以滤渣中可能含有铜,错误;B、如果滤渣只含一种金属,该金属可能是银,说明锌可能与部分的硝酸银反应,滤液中的溶质可能含有硝酸银、硝酸铜、硝酸锌三种,正确;C、在滤渣中加入稀盐酸有气泡产生,说明滤渣中有金属锌,则硝酸铜、硝酸银完全反应,所以滤液中的溶质只含有硝酸锌,错误;D、在滤渣中加入稀盐酸没有气泡产生,则滤渣一定含有Ag,可能含有Cu,错误。故选B。
现有甲、乙、丙、丁四种颗粒大小相同的金属,分别投入相同的稀硫酸中,只有甲、乙表面有气泡产生,且甲产生气泡较快;再把丙和丁投入相同的硝酸银溶液中,过一会儿,丙的表面有银析出,而丁没有变化。则四种金属的活动性顺序是( )
A.甲>乙>丁>丙 B.丁>乙>丙>甲
C.甲>乙>丙>丁 D.乙>甲>丁>丙
C
【解析】
由题意可知,甲、乙、丙、丁四种颗粒大小相同的金属,分别投入等质量等浓度的稀硫酸中,只有甲、乙表面有气泡产生,且甲产生气泡较快,可推出甲的活泼性大于乙,且都大于丙、丁;由再把丙和丁投入相同的硝酸银溶液中,过一会儿,丙的表面有银析出,而丁没变化,说明了丙的活泼性大于丁。由此可得出甲、乙、丙、丁四种的金属的活泼性大小是:甲>乙>丙>丁,所以C正确,A、B、D错误。故选C。
取一定量打磨后的铝片于某容器中,再逐渐加入稀盐酸。加入稀盐酸的质量与有关量的变化关系图错误的是
A.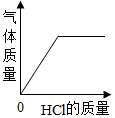 B.
B.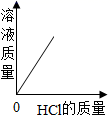 C.
C.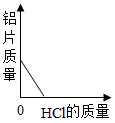 D.
D.
B
【详解】
A、向一定量的铝片中加入稀盐酸,随着盐酸的加入,氢气质量不断增大,至铝片完全反应后不再产生气体;图示正确;故不符合题意;
B、向一定量的铝片中加入稀盐酸,随着盐酸的加入,溶液的质量不断增大,铝元素反应后进入到溶液中,但由于又产生了氢气,其质量增大仍然较快,至铝片完全反应后不再产生气体;继续加入盐酸,溶液增加的质量只是盐酸溶液的质量,变化会比开始时变化更缓和一点;图示错误;故符合题意;
C、向一定量的铝片中加入稀盐酸,随着盐酸的加入,铝片不断反应,质量在不断减少,完全反应后铝片质量为零;图示正确;故不符合题意;
D、铝元素的质量是一定的,不管是否发生反应,其质量始终等于开始加进去的铝片的质量,图示正确;故不符合题意;
故选B
下表物质中含有少量杂质,其中除杂方法正确的是
| 物质 | 杂质 | 除去杂质的方法 | |
| A | CaCl2溶液 | HCl | 滴入碳酸钠溶液 |
| B | CO2 | O2 | 通过灼热的铜网 |
| C | NaOH | Na2CO3 | 加入稀盐酸至不再产生气泡 |
| D | CuO | Cu | 加足量稀盐酸,充分搅拌后再过滤 |
A.A B.B C.C D.D
B
【解析】
A、碳酸钠溶液与盐酸反应生成氯化钠,氯化钠是新的杂质,违背除杂原则,错误;B、氧气与灼热的铜网反应生成氧化铜,能除去氧气且不引入新的杂质,正确;C、稀盐酸与氢氧化钠溶液反应,违背除杂原则,错误;D、稀盐酸与氧化铜反应,违背除杂原则,错误。故选B。
点睛:解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键。
本卷还有95题,登录并加入会员即可免费使用哦~

该作品由: 用户王磊分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。