下列图示实验操作中,正确的是( )
A.  点燃酒精灯 B.
点燃酒精灯 B. 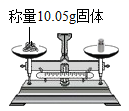 称量固体
称量固体
C. 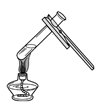 液体加热 D.
液体加热 D. 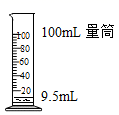 量取液体
量取液体
C
【详解】
A、点燃酒精灯,应该用火柴点燃,用燃着的酒精灯引燃另一只,易引发灯内酒精着火,甚至酒精灯爆炸,操作错误;
B、用天平称量一定量的固体时,只能精确到0.1g,错误;
C、加热试管中的液体时,液体的量不能超过试管容积的三分之一,且要用外焰加热,先均匀加热,后对准药品固定加热。试管口向上倾斜,与桌面呈45°角,操作正确;
D、量取一定量液体时,被量液体的体积应略小于量筒的量程,应该选用10毫升量筒,错误。
故选C。
小明在学完化学用语之后,完成了家庭作业。他的作业中正确的是( )
A.3H﹣﹣3个氢元素
B.C60﹣﹣60个碳原子
C.![]() ﹣﹣氧化铁中铁的化合价显+3价
﹣﹣氧化铁中铁的化合价显+3价
D.NaCO3﹣﹣碳酸钠
C
【解析】
A、由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故3H可表示3个氢原子,元素没有个数的说法,故选项错误;
B、C60可表示1个C60分子,故选项错误;
C、由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故![]() 可表示氧化铁中铁的化合价显+3价,故选项正确。
可表示氧化铁中铁的化合价显+3价,故选项正确。
D、碳酸钠中钠元素显+1价,碳酸根显﹣2价,其化学式为:Na2CO3,故选项错误。故选C。
【点睛】
原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字;分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号前加上相应的数字;化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后。
下列宏观事实对应的微观解释不正确的是
| 选项 | 宏观事实 | 微观解释 |
| A | 10mL水和10mL酒精混合后体积小于20mL | 分子间有间隙 |
| B | 温度计内汞柱液面上升 | 原子体积变大 |
| C | 氢气燃烧生成水 | 分子种类改变 |
| D | 花的香味鼻子闻得到眼睛却看不见 | 构成物质的粒子很小且不断运动 |
A.A B.B C.C D.D
B
【详解】
A、将10mL水和10mL酒精混合后体积小于20mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,故选项解释正确;
B、由于原子间有间隔,温度升高时,汞原子间的间隔增大,所以温度计内汞柱液面上升,原子的体积不变,故选项解释错误;
C、氢气燃烧生成水,有新物质生成,是化学变化,分子的种类发生了变化,故选项解释正确;
D、花的香味鼻子闻得到眼睛却看不见,是由于构成物质的粒子很小且不断运动,故选项说法正确。
故选B。
【点睛】
分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种物质的分子性质相同,不同物质的分子性质不同;分子在化学变化中发生了变化。
化学实验小组做实验时记录了下列实验现象,其中正确的是( )
A.红磷在空气中燃烧产生大量的白色烟雾
B.硫磺在空气中燃烧产生淡蓝色火焰,生成有刺激性气味的气体
C.木炭在氧气中剧烈燃烧,发白光,生成二氧化碳气体
D.铁丝在空气中燃烧,火星四射,生成黑色固体
B
【解析】
A、红磷燃烧产生的是大量的白烟,没有雾,故错误;
B、硫磺在空气中燃烧产生淡蓝色火焰,生成有刺激性气味的气体,正确;
C、描述实验现象时,不能说明物质的具体名称,故错误;
D、铁丝在空气中不能正常燃烧,故错误。故选C。
【点睛】
烟是固体小颗粒形成的,雾是液体小液滴形成的。
某同学制作的药品标签如图所示,其中化学式书写不正确的是( )
A.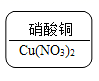 B.
B.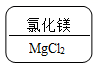 C.
C.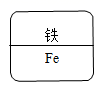 D.
D.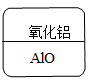
D
【详解】
氧化铝中氧元素的化合价为-2,铝元素的化合价为+3,应用最小公倍数法写化合物的化学式,首先标出元素的化合价,如![]() ,化合价绝对值的最小公倍数为6,则
,化合价绝对值的最小公倍数为6,则![]() ,
,![]() ,所以氧化铝的化学式为:
,所以氧化铝的化学式为:![]() 。故选D。
。故选D。
本卷还有45题,登录并加入会员即可免费使用哦~

该作品由: 用户王骞分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。