分子筛(又称为沸石,主要成分为水和硅铝酸钠)可作为催化剂或吸附剂等,以高岭[主要成分为Al2Si2O5(OH)4]、烧碱等为主要原料生产分子筛的工艺流程如下:
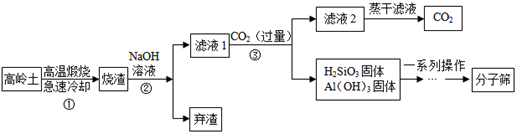
(1)步骤①所得烧渣中主要含有两种固体氧化物,一种是SiO2,其中硅元素的化合价是_____;另一种氧化物的化学式是____________。
(2)步骤2加入NaOH溶液前需将烧渣粉碎,其目的是________。
(3)步骤②和③均涉及的操作是__________,实验室进行此操作所需的玻璃仪器有烧杯、玻璃棒、______。
(4)步骤③发生的反应之一是Na2SiO3溶液和通入的CO2气体反应生成偏硅酸(H2SiO3)沉淀和碳酸氢钠,该反应的化学方程式为____________。
(5)上述流程中可以循环利用的物质(水除外)是________________________。
+4 Al2O3 增大反应物之间的接触面积,使反应更充分 过滤 漏斗 ![]() 二氧化碳
二氧化碳
【详解】
(1)氧元素通常为-2价,设硅元素的化合价是x,根据化合物中,正、负化合价的代数和为零,可得:x+(-2)×2=0,x=+4;
根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Al、Si、O、H,生成物含有两种固体氧化物,氧化物是由两种元素组成,其中一种元素为氧元素的化合物,其中一种固体氧化物为SiO2,故另一种固体氧化物应含铝元素,应是Al2O3;
(2)将烧渣粉碎,可以增大反应物之间的接触面积,使反应更充分;
(3)步骤②和③均实现了固液分离,故涉及的操作是过滤;
过滤需要用到的玻璃仪器是烧杯、漏斗、玻璃棒;
(4)步骤③发生的反应之一是Na2SiO3溶液和通入的CO2气体反应生成偏硅酸(H2SiO3)沉淀和碳酸氢钠,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Na、Si、O、C,生成物中含H、Si、O,Na、C,故水参与了反应,该反应的化学方程式为:![]() ;
;
(5)由图可知,上述流程中,二氧化碳既是反应物,又是生成物,可以循环利用。
某学习小组利用如图所示装置对氯酸钾制氧气进行探究学习。

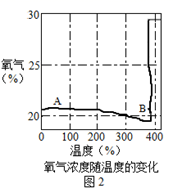
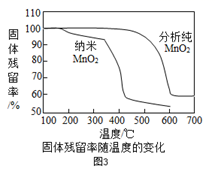
资料:①KClO3的熔点约为356℃,MnO2在加热条件下不分解;②KClO3分解时,传感器得到氧气浓度随温度的变化示意图及使用不同催化剂时的固体残留率分别如图和如图所示。
(1)由如图1可知,KClO3分解温度__________(填“高于”、“等于”或“低于”)其熔点。
(2)如图2中A→B段氧气浓度逐渐降低的可能原因是______________。
(3)分析如图3可知,对KClO3分解催化效果更好的催化剂是_____________。
(4)为证实MnO2的催化作用,小组同学利用如图装置进行如表所示的实验,请完成填表。
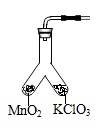
| 步骤 | 实验操作 | 实验现象 |
| Ⅰ | 检查装置气密性 | (气密性良好) |
| Ⅱ | 分别在“Y形管两支管中加入少量MnO2和KClO3,塞紧橡皮塞,用带火星木条放在导管口 | 没有_________ |
| Ⅲ | 分别先后加热MnO2和KClO3,用带火星木条放在导管口,加热__________(填“左”或“右”)侧支管后,带火星木条复燃 | _________ |
| Ⅳ | 冷却后,将"Y”形管左侧支管中部分MnO2混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口 | _________ |
(5)步骤Ⅳ的实验现象不能说明MnO2是KClO3分解的催化剂,因为还需要证明___________。
(6)将29.4gKC1O3和MnO2混合物以5:1配比加热至完全反应,如图中m的值应为_____g。
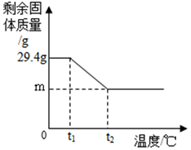
高于 试管内气压增大,排出一部分空气,使氧气浓度降低。 纳米MnO2 没有明显现象 右 木条长时间才能复燃 加热时间短于步骤III,木条即复燃。 质量和化学性质不变 19.8g
【详解】
(1)通过图中的数据可知氯酸钾的分解温度大约是380℃,以及从资料中可知氯酸钾的熔点是356℃,所以KClO3分解温度高于其熔点;故填:高于。
(2)A→B段是在氯酸钾分解前,实验装置内的空气受热膨胀,会发生逸出,导致装置内的氧气浓度降低,所以在KClO3分解前,传感器得到氧气浓度降低的可能原因是:试管内气压增大,排出一部分空气,氯酸钾还没有分解生成氧气;故填:试管内气压增大,排出一部分空气,使氧气浓度降低。
(3)根据图3可知,在氯酸钾开始分解时相同温度下都是纳米二氧化锰的残留率低于分析纯二氧化锰的,且纳米二氧化锰残留率出现最多降幅时,温度为400℃左右,低于分析纯二氧化锰550℃,所以使用纳米二氧化锰催化效果好;故填:纳米MnO2。
(4)II、氯酸钾和二氧化锰单独存放时都不能自己产生氧气,因此带火星木条放在导管口,木条不会发生什么变化,故填:没有明显现象。
III、氯酸钾单独受热分解生成的氧气速率较慢,单独加热二氧化锰不会生成氧气,因此用带火星木条放在导管口有氯酸钾的即右侧支管在加热后,木条复燃,实验现象是木条长时间才能复燃。故填:右;木条长时间才能复燃。
IV、二氧化锰可以加快氯酸钾的分解速率,所以在二氧化锰和氯酸钾混合后再加热,产生氧气的速率会比单独加热氯酸钾的快,因此实验现象是加热时间短于步骤III,木条即复燃。故填:加热时间短于步骤III,木条即复燃。
(5)在化学反应里能改变其他物质的化学反应速率(既能提高也能降低),而本身的质量和化学性质在化学反应前后都没有发生改变的物质叫做催化剂,所以步骤IV的实验现象不能说明MnO2是KClO3分解的催化剂,还需证明在此反应中MnO2的质量和化学性质不变;故填:质量和化学性质不变。
(6)29.4gKClO3和MnO2混合物以5:1,所以氯酸钾的质量为:29.4g×![]() =24.5g,二氧化锰的质量为:29.4g−24.5g=4.9g。
=24.5g,二氧化锰的质量为:29.4g−24.5g=4.9g。
设生成氯化钾的质量为x。
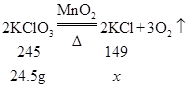
![]()
x=14.9g
所以剩余固体的质量为:14.9g+4.9g=19.8g,即m=19.8g。
请根据下列实验装置回答问题。

(1)实验1中,仪器a的名称是_____,其中发生反应的化学方程式是________。
(2)实验2烧瓶中发生反应的化学方程式是HCOOH H2O+CO↑,用此法制得的CO气体中通常含有杂质,可能的杂质有___________。反应开始一段时间后,即使盖灭酒精灯反应也能持续进行,说明该反应是___________反应。
H2O+CO↑,用此法制得的CO气体中通常含有杂质,可能的杂质有___________。反应开始一段时间后,即使盖灭酒精灯反应也能持续进行,说明该反应是___________反应。
(3)实验3的操作步骤如下:①____________(分别填甲、乙的操作)通入混合气体,可收集到一种气体;②然后,通过适当操作,并滴加M溶液,又可收集到另一种气体,M溶液是____________,此时收集到的气体是___________。
锥形瓶 CaCO3+2HCl=CaCl2+H2O+CO2↑ 甲酸或二氧化碳 放热 关闭乙,打开甲 稀盐酸或稀硫酸 二氧化碳
【详解】
(1)实验1中,仪器a是锥形瓶。该装置用于实验室制取二氧化碳,实验室使用块状药品大理石和液体药品稀盐酸在常温下混合制取,反应生成氯化钙、水和二氧化碳。故答案为:锥形瓶、CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)甲酸具有一定的挥发性,根据质量守恒定律,则生成的一氧化碳气体中会混有少量的甲酸气体或二氧化碳气体。反应开始一段时间后,即使盖灭酒精灯,反应也能继续进行,则说明该反应是放热反应。故答案为:甲酸、放热;
(3)实验3的操作步骤如下:关闭乙,打开甲通入混合气体,则二氧化碳气体被氢氧化钠溶液吸收。则此时可以收集到CO,溶液为碳酸钠溶液。为了得到另外的二氧化碳气体,则可以加入酸,使酸和碳酸钠反应生成二氧化碳气体并收集,则M为稀盐酸或稀硫酸。故答案为:关闭乙,打开甲、稀盐酸或稀硫酸、二氧化碳。
硫酸镁溶液可以和氢氧化钠溶液反应,该反应前后溶液中主要存在的离子(每种图形代表不同离子)如图所示。

(1)该实验过程中可以观察到的现象是______________
(2)图示中“![]() ”的离子符号是___________,滴管中盛放的是_________溶液(填化学式)。
”的离子符号是___________,滴管中盛放的是_________溶液(填化学式)。
(3)氨水(NH3•H2O)也能和硫酸镁反应,原因是氨水和氢氧化钠溶液中均含有一种相同离子,该离子是___________。(填离子符号)
(4)某同学用镁粉溶于100g稀硫酸反应得到的溶液和溶质质量分数为20%的氢氧化钠溶液恰好充分反应,沉淀经过滤、洗涤、干燥后称量,测得质量为5.8g。写出生成沉淀的化学方程式并计算消耗氢氧化钠溶液的质量(列式计算)。________
有白色沉淀生成 Mg2+ NaOH OH- 2NaOH+MgSO4=Mg(OH)2↓+Na2SO4,消耗氢氧化钠溶液的质量为40g
【分析】
氢氧化钠和硫酸镁反应生成氢氧化镁沉淀和硫酸钠。
根据图像分析可知,反应后是硫酸钠溶液,硫酸钠在水溶液中电离出2个钠离子和1个硫酸根离子,则![]() 是硫酸根离子,
是硫酸根离子,![]() 是钠离子。则
是钠离子。则![]() 是氢氧根离子,
是氢氧根离子,![]() 是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。
是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。
【详解】
(1)氢氧化钠和硫酸镁反应生成氢氧化镁沉淀和硫酸钠,观察到的现象是溶液中有白色沉淀生成。故答案为:有白色沉淀生成;
(2)通过分析可知,图中![]() 表示的是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。故答案为:Mg2+、NaOH;
表示的是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。故答案为:Mg2+、NaOH;
(3)氨水属于碱,和氢氧化钠在水溶液中均能电离出氢氧根离子。故答案为:OH-;
(4)设消耗氢氧化钠的质量为x。
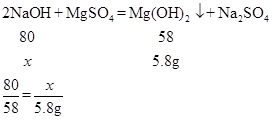
解得x=8g
则消耗氢氧化钠溶液的质量为:8g÷20%=40g。
2019年10月,常州地铁1号线顺利建成通车,极大方便了人们的出行。
(1)地铁车制动盘使用合金锻钢制作,主要是利用该合金耐高温______________等特性。
(2)地铁轨道的主要材料是锰钢,其硬度比纯铁______________。
(3)高铁在建造时使用了大量的新材料,下列属于金属材料的是___________(填序号)
a.生产车头的玻璃钢 b.制造高铁车身的镁铝合金 c.制造轨道枕木的聚氨酯材料 d.建筑高铁路基的钢筋混凝土
(4)比较两种铁矿石磁铁矿(主要成分Fe3O4)和菱铁矿(主要成分FeCO3),从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是_____________。
(5)地铁轨道焊接时,可用铝热反应:用铝和氧化铁在高温条件下发生置换反应,得到铁。该反应的化学方程式是_________。
耐磨(答案合理即可) 大 b 磁铁矿中铁元素含量更高 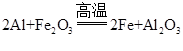
【详解】
(1)地铁车制动盘使用合金锻钢制作,制动盘在启动和停止时,车体会摩擦,说明该合金具有耐磨性。故答案为:耐磨;
(2)合金的硬度比组成它们的金属硬度大,则锰钢的硬度比纯铁的硬度大。故答案为:大;
(3)a、玻璃钢是玻璃纤维与合成材料复合而成的一种特殊材料,属于复合材料。a错误;
b、镁铝合金属于合金,纯金属和合金属于金属材料。b正确;
c、聚氨酯材料属于有机合成材料。c错误;
d、钢筋混凝土是用钢筋和水泥、沙子等材料制成的,属于复合材料。d错误。
故答案为:b;
(4)在Fe3O4中,铁元素的质量分数为:![]() 。在FeCO3中,铁元素的质量分数为:
。在FeCO3中,铁元素的质量分数为:![]() 。所以磁铁矿中铁元素的含量更高。故答案为:磁铁矿中铁元素的含量更高;
。所以磁铁矿中铁元素的含量更高。故答案为:磁铁矿中铁元素的含量更高;
(5)根据质量守恒定律可知,反应前后元素的种类不变。则铝和氧化铁在高温下发生置换反应,则置换出铁,同时生成氧化铝。故答案为: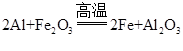 。
。
本卷还有24题,登录并加入会员即可免费使用哦~

该作品由: 用户小小分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。