将氢氧化钠和硫酸钠的混合物20.7 g放入82.3 g 水中使其完全溶解,再加入147 g溶质质量分数为10%的稀硫酸,恰好完全反应,试计算:
(1)147 g 10%的稀硫酸的溶质质量。
(2)原混合物中氢氧化钠的质量。
(3)反应后所得溶液中溶质质量分数。
解:(1)147 g 10%的稀硫酸的溶质质量为147 g×10%=14.7 g。
(2)设原混合物中氢氧化钠的质量为x,生成Na2SO4的质量为y。
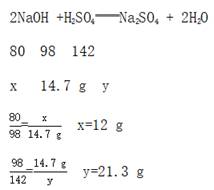
(3)所得溶液中溶质质量分数为![]() 。
。
答:(1)147 g 10%的稀硫酸的溶质质量是14.7 g;(2)原混合物中氢氧化钠的质量是12 g;(3)反应后所得溶液中溶质质量分数是12%。
室温下,将盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入盐酸的质量而变化的曲线如图11-16 所示。
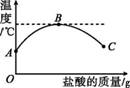
图11-16
(1)由图可知,盐酸与氢氧化钠溶液的中和反应是 (填“吸热”“放热”或“无热量变化”)反应。
(2)在A点溶液中加入石蕊,溶液呈 色。
(3)B点溶液的溶质是 (填化学式)。
(4)B到C的过程中溶液的pH逐渐 (填“增大”“减小”或“无变化”)。
(5)在C点溶液中加入碳酸钙,现象为 ,化学方程式为 。
(1)放热 (2)蓝 (3)NaCl (4)减小
(5)有气泡产生 CaCO3+2HCl![]() CaCl2+H2O+CO2↑
CaCl2+H2O+CO2↑
(2019·百色改编)某工厂化验室用质量分数为5.6%的氢氧化钾溶液洗涤50 g石油产品中的残余硫酸。pH的变化关系如图11-7所示。计算这种石油产品中硫酸的溶质质量分数。
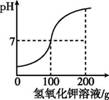
图11-7
解:设50 g石油产品中硫酸的质量为x。
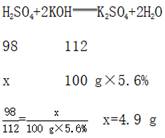
这种石油产品中硫酸的溶质质量分数为
![]() 。
。
答:这种石油产品中硫酸的溶质质量分数为9.8%。
(2019·绥化)酸、碱、盐在生产生活中有着广泛的应用。
(1)氢氧化钠溶液与稀硫酸反应时,溶液pH变化如图11-4所示。
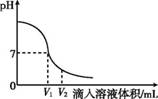
图11-4
①根据图示判断该实验是将 滴入到 中。
②滴入溶液体积为V2 mL时,溶液中溶质为 (填化学式)。此时滴入石蕊溶液的现象为 。
(2)测定某酸溶液pH时,如果放pH试纸的玻璃片上的水没有擦干就进行测定,会使测得的pH (填“偏大”或“偏小”)。
(3)用来改良酸性土壤的碱是 。
(1)①稀硫酸 氢氧化钠溶液
②H2SO4、Na2SO4 石蕊溶液变红
(2)偏大
(3)熟石灰(或氢氧化钙或消石灰)
(解析) (1)①开始时溶液的pH大于7,故开始为碱性溶液,因此是将稀硫酸滴入到氢氧化钠溶液中;②滴入溶液体积为V2 mL时,稀硫酸过量,故溶液中溶质为生成的硫酸钠和剩余的硫酸,能使石蕊溶液变红。(2)酸溶液的酸性越弱,pH越大,测定某酸溶液pH时,如果放pH试纸的玻璃片上的水没有擦干就进行测定,会使酸性溶液被稀释,酸性减小,测得的pH偏大。(3)用来改良酸性土壤的碱是比较经济廉价、碱性稍弱的熟石灰。
等质量、等质量分数的稀硫酸和氢氧化钠溶液混合,充分反应后,所得溶液加入下列物质不能发生反应的是 ( )
A.BaCl2 B.CuO
C.Cu(NO3)2溶液 D.CO2
B
本卷还有27题,登录并加入会员即可免费使用哦~

该作品由: 用户贾长丽分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。