赣州市素有“世界钨都”的美称。钨在自然界的存在形式之一是黑钨矿(主要成分是铁和锰的钨酸盐,化学式分别是FeWO4、MnWO4) ,冶炼金属钨的工艺流程如下:
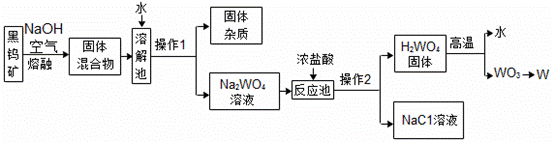
(1)操作I和操作Ⅱ为相同的操作,该操作的名称是___________。
(2)上述 流程中可循环使用的物质是______________。
(3)反应池中发生反应的化学方程式为__________。
(4)碳、氢气、一氧化碳都能将WO3固体还原成W,从有利于提高生成物纯度和环保的角度分析,流程中WO3→W的还原剂应该选用_________。
(1)过滤 (2)水 (3)![]() (4) 氢气
(4) 氢气
【解析】(1)操作I和操作Ⅱ分别得到一种固体和一种溶液,所以该操作为过滤;(2)溶解池需要用水作溶剂,而该流程中高温煅烧H2WO4固体时生成WO3和水,所以水可以被循环利用;(3)由工艺流程图可知,反应池中的反应物为Na2WO4和浓盐酸,通过复分解反应生成了NaCl 和H2 WO4,所以反应池中发生反应的化学方程式为![]() ;(4)碳为固体,能将WO3固体还原成W,但是反应物之间的接触面积较小,所以生成物纯度相对较低,且碳不易与生成物W分离;一氧化碳也能将WO3固体还原成W ,但是一氧化碳有毒,不利于环保;氢气能将WO3固体还原成W和水,生成物纯度较高且不污染空气,所以流程中WO3→W的还原剂应该选用氢气。
;(4)碳为固体,能将WO3固体还原成W,但是反应物之间的接触面积较小,所以生成物纯度相对较低,且碳不易与生成物W分离;一氧化碳也能将WO3固体还原成W ,但是一氧化碳有毒,不利于环保;氢气能将WO3固体还原成W和水,生成物纯度较高且不污染空气,所以流程中WO3→W的还原剂应该选用氢气。
空气是宝贵的自然资源,下图是以空气等为原料合成尿素CO(NH2)2的流程(部分产物略去)。请按要求回答下列相关问题:
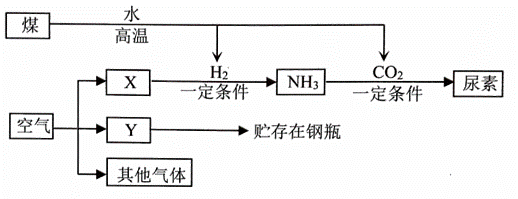
(1)X的化学式为_____;Y气体名称是_____,钢瓶外壁涂___色;其他气体的主要成分是______。
(2)分离空气的常用方法有以下两种:
①将液态空气蒸发,先得到X。则沸点:X____Y(选填“大于”“等于”“小于”,下同);
②分子筛分离。分子筛是一种内部分布有均匀微小孔径的固体,通过特制的分子筛把空气中的氧分子吸入孔穴而与其它分子分离,则分子大小:X______Y。
(3)写出流程中生成NH3的化学方程式_________。
(1)N2 氧气 蓝 稀有气体
(2)①小于 ②大于
(3)N2 + 3H2  2NH3
2NH3
【解析】(1)根据流程图可知,X与氢气能转化为NH3,根据质量守恒定律可知,X中存在氮元素,X可从空气分离得到,所以X气体的化学式是N2,空气中主要含有氮气和氧气,空气中氮气的体积分数是78%,氧气体积分数是21%,稀有气体体积分数是0.94%,二氧化碳的体积分数是0.03%。Y气体是氧气,贮存氧气钢瓶外壁涂蓝色;其他气体的主要成分是稀有气体;(2)①将液态空气气化,首先分离出氮气。则氮气的沸点小于氧气;②通过特制的分子筛把空气中的氧分子吸入孔穴而与其它分子分离,氧分子被截留,而其他通过,说明氧分子比氮分子大;(3)根据流程图可知,氮气与氢气在一定条件下能转化为NH3,化学方程式为:N2 + 3H2  2NH3。
2NH3。
工业上炼铁炼钢和轧制钢材的主要流程如下图。
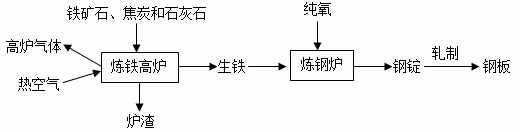
已知生铁的含碳量为 2%-4.3%,钢的含碳量为 0.03%-2%。
(1)赤铁矿在高炉内反应生成铁的主要化学方程式为_______。
(2)炼铁的固体原料需经过粉碎,其目的是_______。
(3)高炉气体中体积分数最大的气体的化学式是_______。炉渣中含有硅酸钙
(CaSiO3),其中硅元素的化合价是_______。
(4)炼钢炉中,通入纯氧的目的是____。将钢锭轧成钢板,体现了金属的__性。
(1)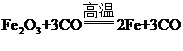
(2)增大反应物接触面积,加快反应速率
(3) N2 +4
(4)使生铁中的碳转化为二氧化碳,降低生铁中碳含量 延展性
【解析】(1)赤铁矿在高炉内与一氧化碳反应生成铁的化学方程式为: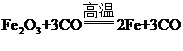 ;
;
(2)炼铁的固体原料需经过粉碎,粉碎的目的是增大反应物接触面积,加快反应速率;(3)氮气的化学性质稳定,热空气中的氮气没有参与反应,所以排放出的高炉气体中也含有氮气,且含量最高;钙元素显+1价,氧元素显-2价,设硅元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+x+(-2)×3=0,则x=+4价;(4)炼钢炉中通入氧气可以使生铁中的碳充分反应,降低含碳量;将钢锭轧成钢板,体现了金属的延展性。
人类文明进步与金属材料发展关系十分密切。
(1)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:
焦炭![]() CO2
CO2![]() CO
CO![]() Fe
Fe
请写出步骤 2 反应的化学方程式:_____。
(2)每年世界上钢铁的产量很高,钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟空气中的水及_____共同作用的结果。
(3)为了防止钢铁锈蚀,人们常采用在其表面涂刷植物油或镀上其他金属等覆盖保护膜的方法。这些方法都能防止锈蚀的共同原理是_____。
(4)工业上用铝土矿(含有 Al2O3 和 SiO2,不考虑其它杂质)制取金属铝的基本流程如图所示:
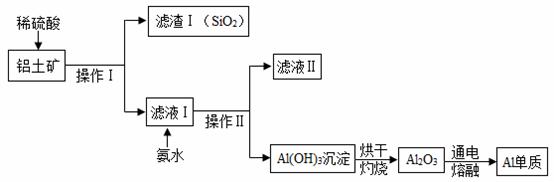
①通过该流程可得出 SiO2 的性质有_____(填序号)。
A 难溶于水 B 不能与稀硫酸反应 C 能与氢氧化钠溶液反应
二氧化硅的结构与金刚石相似,都是由_____(填“原子”、或“离子”)构成的,二氧化硅属于_____(填“酸”、“碱”、“盐”或“氧化物”)。
②铝土矿中氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式为_____。
(5)铝合金被广泛应用于制造飞机、高铁等,这是因为铝合金具有_____、质量轻、耐腐蚀等特 性。铝合金材料的抗腐蚀性是因为_____。
(1)C+CO2![]() 2CO
2CO
(2)氧气
(3) 隔绝氧气和水
(4)①AB 原子 氧化物 ②Al2O3+3H2SO4═Al2(SO4)3+3H2O
(5)硬度大 铝能和氧气反应生成氧化铝保护膜
【解析】(1)步骤 2 中,高温条件下二氧化碳和碳反应生成一氧化碳,反应的化学方程式:
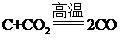 。(2)铁在空气中锈蚀,实际上是铁跟空气中的水及氧气共同作用的结果。(3)这些方法都能防止锈蚀的共同原理是隔绝氧气和水。(4)①通过该流程可得出 SiO2 的性质有难溶于水,不能与稀硫酸反应,故选AB,二氧化硅的结构与金刚石相似,都是由原子构成的,二氧化硅属于氧化物。②氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式为:
。(2)铁在空气中锈蚀,实际上是铁跟空气中的水及氧气共同作用的结果。(3)这些方法都能防止锈蚀的共同原理是隔绝氧气和水。(4)①通过该流程可得出 SiO2 的性质有难溶于水,不能与稀硫酸反应,故选AB,二氧化硅的结构与金刚石相似,都是由原子构成的,二氧化硅属于氧化物。②氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式为:![]() (5)铝合金被广泛应用于制造飞机、高铁等,这是因为铝合金具有硬度大、质量轻、耐腐蚀等特性。铝合金材料的抗腐蚀性是因为铝能和氧气反应生成氧化铝保护膜。
(5)铝合金被广泛应用于制造飞机、高铁等,这是因为铝合金具有硬度大、质量轻、耐腐蚀等特性。铝合金材料的抗腐蚀性是因为铝能和氧气反应生成氧化铝保护膜。
侯德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱和氮肥工业技术的发展作出了杰出的贡献。工业上以半水煤气(主要成分是N2、H2、CO、CO2和H2O)、食盐等为原料制取纯碱的流程如图所示。
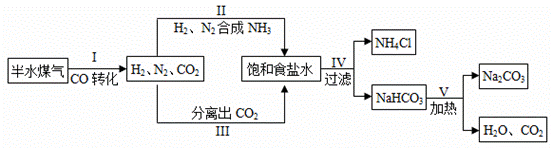
(1)流程中循环利用的物质有H2O和______。
(2)步骤Ⅰ中,在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应实现了CO转化,化学方程式是______。
(3)实验室从混合气体中H2、N2、CO2分离出CO2的实验装置如图所示。广口瓶和分液漏斗中盛放的药品分别是______、______。

(4)除去纯碱中少量碳酸氢钠杂质的方法是______。
(5)纯碱用途广泛。工业上可用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2CO3,达到减少污染、节约资源的目的。反应过程中溶液组成变化如图所示。
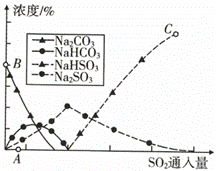
①吸收初期(图中A点以前)反应的化学方程式为______。
②不断通人SO2,最终产物是______。
(1)CO2
(2)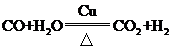
(3)氢氧化钠溶液 稀硫酸
(4)加热至质量不再减少
(5) 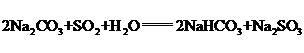 NaHSO3
NaHSO3
【解析】(1)流程中循环利用的物质有H2O和CO2。(2)步骤I中,在使用铜催化剂和加热条件下,半水煤气中一氧化碳和水发生反应生成二氧化碳和氢气,实现了CO转化,化学方程式为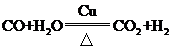 。(3)要从混合气体H2、N2、CO2中分离出CO2,需要先用氢氧化钠吸收,使用的药品是氢氧化钠溶液,然后将二氧化碳释放出,使用的是稀硫酸,故广口瓶和分液漏斗中盛放的药品分别是氢氧化钠溶液、稀硫酸。(4)碳酸氢钠热稳定性差,故除去纯碱中少量碳酸氢钠杂质可以采用加热的方法。(5)①吸收初期是碳酸钠、二氧化硫和水反应生成碳酸氢钠和亚硫酸钠,反应的化学方程式为
。(3)要从混合气体H2、N2、CO2中分离出CO2,需要先用氢氧化钠吸收,使用的药品是氢氧化钠溶液,然后将二氧化碳释放出,使用的是稀硫酸,故广口瓶和分液漏斗中盛放的药品分别是氢氧化钠溶液、稀硫酸。(4)碳酸氢钠热稳定性差,故除去纯碱中少量碳酸氢钠杂质可以采用加热的方法。(5)①吸收初期是碳酸钠、二氧化硫和水反应生成碳酸氢钠和亚硫酸钠,反应的化学方程式为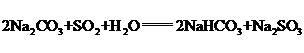 。②不断通入SO2,亚硫酸钠和二氧化硫和水反应生成亚硫酸氢钠,故最终产物是亚硫酸氢钠。
。②不断通入SO2,亚硫酸钠和二氧化硫和水反应生成亚硫酸氢钠,故最终产物是亚硫酸氢钠。
本卷还有25题,登录并加入会员即可免费使用哦~

该作品由: 用户王宏业分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。