某不纯的铁中只含一种杂质,现取该样品5.6g与足量的稀盐酸反应,生成氢气0.21g则铁中所含的杂质可能是( )
A.Cu B.Zn C.Mg D.Ag
C
【解析】设5.6g铁与足量的稀盐酸反应生成氢气的质量为x
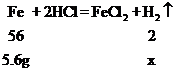 ,
,![]() ,X=0.2g
,X=0.2g
A、如果Fe中混有Cu,Cu不会与稀盐酸反应生成氢气,故生成氢气的质量小于0.2g,故选项A不符合题意;B、如果Fe中混有Zn,Zn、Fe与稀盐酸反应生成的化合物中化合价相同,Zn的相对原子质量比Fe大,等质量的Zn、Fe与足量的稀盐酸反应,Zn产生的氢气比Fe的小,生成氢气的质量小于0.2g,故选项B不符合题意;C、如果Fe中混有Mg,Mg、Fe与稀盐酸反应生成的化合物中化合价相同,Mg的相对原子质量比Fe小,等质量的Mg、Fe与足量的稀盐酸反应,Mg产生的氢气比Fe的大,生成氢气的质量可能为0.21g,故选项C符合题意;D、如果Fe中混有Ag,Ag不会与稀盐酸反应生成氢气,故生成氢气的质量小于0.2g,故选项D不符合题意。故选:C。
镁、锌组成的混合物和足量的盐酸反应,生成氢气0.2g,则混合物的质量可能为( )
A.1.2g B.9.2g C.2.7g D.6.5g
在天平左右两盘中各放一个等质量的烧杯,烧杯中分别盛有等质量的足量的稀硫酸,天平平衡。向左盘烧杯中加入27g10%的氢氧化钠溶液,向右盘烧杯中加入铁粉,若天平最终平衡,则加入铁粉的质量为( )
A.56g B.28g C.27g D.29g
B
【解析】在天平左右两盘中各放一个等质量的烧杯,烧杯中分别盛有等质量的足量的稀硫酸,天平平衡。向左盘烧杯中加入27g10%的氢氧化钠溶液,氢氧化钠和硫酸反应生成硫酸钠和水,没有气体生成,故左盘增重27g,向右盘烧杯中加入铁粉,若天平最终平衡,则右盘参加反应的铁和生成氢气的质量差是27g。
设加入铁粉的质量为x,生成氢气的质量为y,
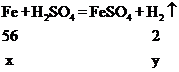 ,
,![]() ,y=
,y=![]() ,x-
,x-![]() =27g ,解得:x=28g;故选B。
=27g ,解得:x=28g;故选B。
6.5g镁、铁、锌三种金属的混合物与200g稀硫酸恰好完全反应。生成0.4g氢气,反应后所得溶液中溶质的总质量是
A.6.1g B.16.1g C.206.lg D.25.7g
D
【解析】由题意6.5g镁、铁、锌三种金属的混合物与200g稀硫酸恰好完全反应,生成硫酸镁、硫酸亚铁、硫酸锌和氢气,反应后所得溶液中溶质为硫酸镁、硫酸亚铁、硫酸锌,由质量守恒定律可知,根据元素守恒,反应后所得溶液中溶质的总质量为镁、铁、锌三种金属的总质量与硫酸根质量之和,已知生成氢气的质量为0.4g,则硫酸中氢元素的质量为0.4g,则硫酸的质量为![]() ,硫酸根的质量为
,硫酸根的质量为![]() ,则硫酸镁、硫酸亚铁、硫酸锌的总质量为6.5g+19.2g=25.7g,D选项正确,符合题意。故选D。
,则硫酸镁、硫酸亚铁、硫酸锌的总质量为6.5g+19.2g=25.7g,D选项正确,符合题意。故选D。
现有某锌铝合金(Zn-A1)样品8.3g,将其放入200g稀硫酸中,经测定恰好完全反应,蒸发结晶,称量所得固体质量为27.5g,则所用稀硫酸的溶质质量分数为( )。
A.6.26% B.9.8% C.19.6% D.22.6%
B
【解析】锌铝合金的混合物8.3g与足量的稀硫酸完全反应后,生成硫酸镁、硫酸锌、硫酸亚铁的混合物27.5g,根据反应前后元素质量不变,则硫酸镁、硫酸锌、硫酸亚铁三种物质的混合物中含硫酸根的质量为27.5g-8.3g=19.2g,硫酸的化学式为H2SO4,则硫酸的质量为:![]() ×100%=19.6g,则所用稀硫酸的溶质质量分数为:
×100%=19.6g,则所用稀硫酸的溶质质量分数为:![]() ×100%= 9.8%。故选B。
×100%= 9.8%。故选B。
本卷还有65题,登录并加入会员即可免费使用哦~

该作品由: 用户风影分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。