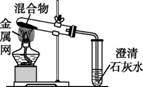
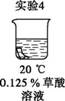
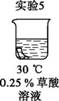
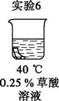
为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5 g进行系列实验。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4 ![]() CuSO4+H2O+Cu。
CuSO4+H2O+Cu。
【进行实验】
实验1:取质量比1∶11的木炭粉和氧化铜混合物1.3 g,进行实验。
| 序号 | 装置 | 反应后物质的颜色、状态 |
| 1-1 |
| 黑色粉末中混有少量红色固体 |
| 1-2 |
| 红色固体有金属光泽,混有极少量黑色物质 |
【解释与结论】
(3)实验1的目的是 。
(3)探究最佳的加热方式
为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5 g进行系列实验。
【查阅资料】
①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4 ![]() CuSO4+H2O+Cu。
CuSO4+H2O+Cu。
【进行实验】
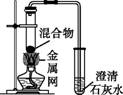
实验2:取一定量的混合物,用图所示装置进行实验。
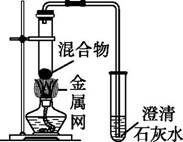
| 序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
| 2-1 | 1∶9 | 红色固体有金属光泽 | 混有少量黑色物质 |
| 2-2 | 1∶10 | 混有很少量黑色物质 | |
| 2-3 | 1∶11 | 混有极少量黑色物质 | |
| 2-4 | 1∶12 | 无黑色物质 | |
| 2-5 | 1∶13 | 混有较多黑色物质 | |
【解释与结论】
(4)实验2的结论是 。
(4)在加热方式相同时木炭与氧化铜反应的最佳质量比为1∶12
同学们在实验室用图所示装置制取氧气。
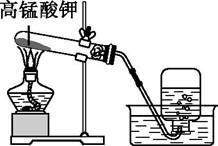
【查阅资料】
草酸溶液能将棕褐色物质除去。
【提出问题】
哪些因素能加快草酸除去棕褐色物质的速率?
【进行实验】
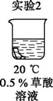
将均匀染为棕褐色的抹布剪成大小相同的小布条进行实验。
| 实验 编号 |
|
|
|
| 现象 | 颜色 没有褪去 | 70秒后 颜色褪去 | 98秒后 颜色褪去 |
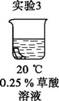
| 实验 编号 |
|
|
|
| 现象 | 150秒后 颜色褪去 | 51秒后 颜色褪去 | 40秒后 颜色褪去 |
【解释与结论】
(4)证明升高温度能加快草酸除去棕褐色物质的速率,需要对比 (填实验序号)。
(5)由实验2、3、4可以得出的结论是
。
(4)3、5、6
(5)温度等其他条件相同时,草酸溶液浓度增大能加快草酸除去棕褐色物质的速率
【解析】(4)证明升高温度能加快草酸除去棕褐色物质的速率,应控制草酸溶液的浓度相同,温度不相同,需要对比实验3、5、6。(5)实验2、3、4中,其他条件相同,草酸溶液的浓度不相同,根据实验现象可以得出的结论是其他条件相同时,草酸溶液浓度增大能加快草酸除去棕褐色物质的速率。
实验课上,某小组的同学用生石灰进行“化学反应中能量的变化”实验时发现:向块状生石灰中加入适量水后没有明显的温度变化。为确定其原因,进行了如下实验探究。
【提出问题】生石灰是否变质?其成分是什么?
【查阅资料】氢氧化钙溶解过程中无明显温度变化,与盐酸反应无气体生成。
【猜想与假设】同学们认为生石灰样品已经变质,并对其成分作出了如下4种猜想。
猜想1:氧化钙和氢氧化钙;
猜想2:氧化钙和碳酸钙;
猜想3:氢氧化钙和碳酸钙;
猜想4:氧化钙、氢氧化钙和碳酸钙。
【进行实验】同学们将少量样品研碎后,按如图T5-8所示过程进行实验。
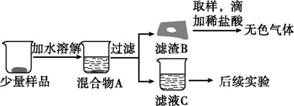
图T5-8
(1)在溶解过程中用温度计测量液体的温度,发现温度计示数升高,说明样品中应该含有氧化钙。结论:猜想3不成立。
(2)滤渣B中一定含有碳酸钙。结论:①块状生石灰表面发生变质;②猜想1不成立。
(3)为验证滤液C的成分,进行后续实验。
| 实验操作 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,滴加适量碳酸钠溶液 | 溶液变 浑浊 | ①滤液中溶质为氢氧化钙 ②猜想4成立,猜想2不成立 |
【反思与评价】上述实验过程能否得出猜想4成立、猜想2不成立的结论,并说明理由:
。
不能。样品溶解时,CaO与H2O反应生成的Ca(OH)2也存在于滤液C中,因此无法确定滤液C中的Ca(OH)2一定是原样品中的
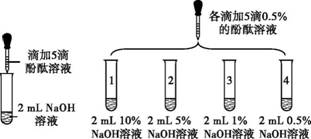
众所周知,酚酞溶液遇NaOH溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
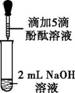
【提出问题】分组实验中,出现意想不到现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成。
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关。
Ⅱ.红色褪去,与NaOH溶液的浓度有关。
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关。
【进行实验】
| 实验 | 实验操作 | 实验现象 | |
| 1 | 向盛有2 mL Na2CO3溶液的试管中滴加5滴0.5%的酚酞溶液 | 溶液变红 | |
| 2 |
| 1号试管 | 0.1 min红色褪去 |
| 2号试管 | 5 min红色褪去 | ||
| 3号试管 | 30 min红色明显变浅 | ||
| 4号试管 | 120 min红色无明显变化 | ||
| 3 | 取3支试管,分别加入2 mL水,…… | 酚酞溶液浓度/% | 浑浊程度 |
| 5 | 大量浑浊物 | ||
| 2 | 少量浑浊物 | ||
| 0.5 | 无浑浊物 | ||
【解释与结论】
(1)NaOH与CO2反应的化学方程式为 。
(2)实验1的现象表明,猜想与假设Ⅰ (填“成立”或“不成立”)。
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是 。
(4)实验3的操作步骤:取3支试管,分别加入2 mL水, 。
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为0.5%,建议选用NaOH溶液的浓度为 %。
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是 。
(1)2NaOH+CO2![]() Na2CO3+H2O
Na2CO3+H2O
(2)不成立
(3)NaOH溶液的浓度越大,溶液变红后褪色越快
(4)各滴加5滴浓度为5%、2%、0.5%的酚酞溶液
(5)0.5
(6)未考虑NaOH与出现白色浑浊物是否有关(合理即可)
本卷还有26题,登录并加入会员即可免费使用哦~

该作品由: 用户小小分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。