人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)地壳中含量最高的金属元素是 。
(2)根据下图金属应用实例推断,金属具有的物理性质有 。

(3)日常使用的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。
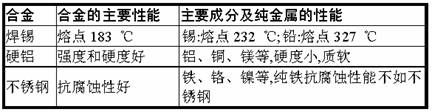
由上表推断,与组成合金的纯金属相比,合金的优点一般有_____(填序号)。
①强度更低 ②硬度更大 ③熔点更高 ④抗腐蚀性更好
(4)人们每年要从金属矿物资源中提取数以吨计的金属。根据所学化学知识,按要求写出两个生成金属的化学方程式:
①___ __
② ___(分解反应)。
解析:
(1)地壳中含量最多的金属元素是铝。
(2)由金属可作电线,推知金属具有导电性;金属可拉成丝,可知金属具有延展性;金属可制造炊具,可知金属具有导热性。
(3),可用对比、分析、归纳的方法进行:表中焊锡合金与铅、锡两种金属的熔点相比,没有金属单质的熔点高,故③错;硬铝与金属单质相比强度和硬度较好,故①错,②正确;不锈钢与金属单质铁相比抗腐蚀性更好,故④正确。
![]()
![]() ①__ _____________________ _________________________ (置换反应)。
①__ _____________________ _________________________ (置换反应)。
② ____________________________(分解反应)
铜锈的主要成分是铜绿[Cu2(OH)2CO3],某同学为了探究铜在空气中生锈的条件,利用如图所示的装置A、B、C进行实验,经过一个月的观察,该同学发现B中的铜丝生锈而A、C中铜丝无明显变化。由此该同学得出结论:铜生锈的主要原因是铜与空气中氧气和水相互作用的结果。试回答:
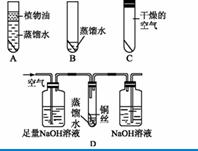
(1)该同学得出的结论正确吗? 。
(2)你认为参与铜生锈的物质还可能有,理由是
(3)为验证你的判断,可用上图所示的D装置进行实验,其中NaOH溶液的作用是 。经过近一个月的观察,D中铜丝基本无变化。由此可认为铜在__ ___的条件下难生锈,故参与铜生锈反应的物质有 。
解析:该题以验证铜“生锈”现象为切入点,通过发现问题→提出问题→收集证据→得出结论→反思与应用,告诉大家解决类似问题的具体方法及程序,并且在这一过程中提出了一系列问题让我们进行解答。该题主要利用对照实验法验证铜生锈的条件,注意比较相同的条件和不同的条件,结合铜锈的成分做出合理的判断。
铁是应用最广泛的金属。据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一。
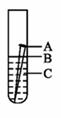
(1)如图所示,取一根光亮铁钉放在自来水中,观察A、B、C三处的变化。几天后,他们会发现 处最先出现铁锈,大家结合书本知识知道,铁在空气中生锈实际是铁与 等物质相互作用发生一系列复杂的化学反应的过程。
(2)写一条防止铁制品生锈的措施 。
(3)在化工生产中可用稀盐酸除去铁制品表面的铁锈。实验课上,小强将生锈铁钉放入稀盐酸中,观察到铁锈逐渐溶解,并伴有气泡产生,溶液由无色逐渐变为黄色,除去铁锈的化学方程式为 ,产生气泡的化学方程式为 。当铁钉表面没有气泡产生时,小强看到溶液仍为黄色,再过一段时间后,小强意外发现黄色溶液逐渐变成了浅绿色。经仔细分析,小强大胆地写出溶液颜色发生改变的化学方程式为 。
解析:
(1)B处铁与水和氧气充分接触,故最先出现铁锈;铁在空气中生锈实际是铁与水和氧气等物质相互作用发生一系列复杂的化学反应的过程;
(2)防止铁生锈原理是隔绝氧气和水,为了防止钢铁锈蚀人们常采用在其表面刷漆、涂油或是镀上其他金属等方法;
(3)铁锈的主要成分是氧化铁,铁锈和盐酸反应能生成氯化铁和水,其反应化学方程式为6HCl+Fe2O3 ==2FeCl3+3H2O,铁锈除去后铁与剩余的盐酸反应生成氯化亚铁和氢气,产生气泡,其反应化学方程式为Fe+2HCl ==FeCl2+H2↑,氯化亚铁溶液呈浅绿色,所以我们可以根据质量守恒定律判断得出:铁与氯化铁反应生成了氯化亚铁,其反应化学方程式为Fe+2FeCl3 ==3FeCl2 。
化学实验室要从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为A、B、C,并设计了如下流程:
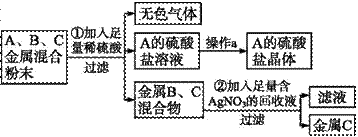
下列说法不正确的是( )
A.操作a的名称是过滤
B.金属C是银
C.A、B、C三种金属的活动性顺序为 A>B>C
D.若A的硫酸盐中A元素显+2价,则A的硫酸盐化学式为MnSO4
解析:硫酸盐溶液,经过操作a后,得到了硫酸盐晶体,所以操作a的名称是蒸发,A项错误;在金属活动性顺序中,铜、银排在氢的后面,所以不能与酸反应放出氢气,由题意可知三种金属中只有A能与稀硫酸反应生成无色气体和A的盐溶液,所以我们判断A是Mn,金属B、C混合物是铜和银的混合物,向它们的混合物中加入足量的含硝酸银的回收液,过滤后得到金属C,说明金属C不能与硝酸银溶液反应,金属B能与硝酸银溶液反应,因此B为铜,C为银,B项正确;由B项分析可知,A、B、C三种金属的活动性顺序为A>B>C,C项正确;已知A的硫酸盐中A元素显+2价,硫酸根显-2价,又因为A是金属Mn,所以A的硫酸盐化学式是MnSO4,D项正确。
某化学兴趣小组为探究铁、铜、锌、银的金属活动性顺序,设计了下图所示的三个实验(其中金属均已打磨,且其形状、大小相同;所用盐酸的溶质质量分数、用量也相同)。下列判断中错误的是( )
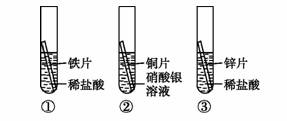
A.通过上述三个实验,不能判断出四种金属的活动性顺序
B.若增加铜锌活动性比较的实验,则可判断出四种金属的活动性顺序
C.通过实验①和③的反应剧烈程度,可判断铁和锌的金属活动性强弱
D.通过实验②的反应现象,可以判断出铜和银的金属活动性强弱
解析:由实验①可知活动性顺序为Fe>H,由实验②可知活动性顺序为Cu>Ag,由实验③可知活动性顺序为Zn>H,又由实验①和③中反应的剧烈程度,可知Zn的活动性大于Fe,综上可见,通过上述三个实验,只能判断出活动性顺序为Zn>Fe,Cu>Ag,并不能判断出四种金属的活动性顺序,若增加一个Fe、Cu活动性比较的实验,则可判断出四种金属的活动性顺序。故选B。
本卷还有10题,登录并加入会员即可免费使用哦~

该作品由: 用户amy分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。