下列CO2的制备装置中,不能起到“随开随制,随关随停”效果的是( )
A.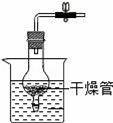
 B.
B.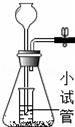
 C.
C.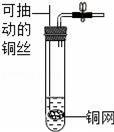
 D.
D.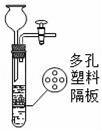

【考点】常用气体的发生装置和收集装置与选取方法.
【专题】常见气体的实验室制法、检验、干燥与净化.
【分析】根据实际操作分析装置是否具有控制反应的发生和停止的效果.
【解答】解:A、用弹簧夹夹住橡胶管时气体排不出去,球形瓶中的气体压强变大从而迫使稀盐酸排出干燥管并与大理石分离,反应停止.放开弹簧夹时,稀盐酸进入干燥管,并和烧杯中的液面相平同时与大理石接触,发生化学反应.所以该装置可以通过控制弹簧夹来达到使盐酸和大理石分离,从而控制反应的发生和停止,不符合题意;
B、固体放在锥形瓶中,酸放在小试管中,酸和固体不能分离,故无法控制反应发生和停止,符合题意;
C、该装置将固体放于铜网上,铜网放入液体,反应生成气体,将铜网拉出,固液分离,反应停止,故不符合题意;
D、大理石反放于隔板上,通过长颈漏斗添加液体,长颈漏斗下端在液面以上,即使夹上弹簧夹液体也无法压入长颈漏斗,故无法控制反应的发生和停止,符合题意.
故选BD.
【点评】通过回答本题掌握了控制反应的发生和停止的实验装置的设计方法,培养了学生分析解决问题的能力.
人们可从铁钛矿(主要成分FeTiO3)制取金属钛(Ti),其在一定条件下的主要反应有:
①FeTiO3+H2=Fe+TiO2+H2O;
②TiO2+2C+2Cl2=TiCl4+2CO;
③TiCl4+2Mg=2MgCl2+Ti
下列叙述正确的是( )
A.反应①中的H2被氧化
B.反应②中钛元素的化合价升高
C.反应③是复分解反应
D.反应②Cl2中的“Cl”得到电子
【考点】常见金属的冶炼方法.
【专题】金属与金属材料.
【分析】A、物质得到氧被氧化
B、根据反应前后钛元素化合价分析
C、根据反应物与生成物的种类以及反应类型的定义分析
D、根据氯气单质由氯原子构成,反应后成为氯离子分析得失电子.
【解答】解:A、反应①中的H2夺取FeTiO3中的氧被氧化成水,正确;
B、反应②中二氧化钛中钛元素化合价为+4价,生成物四氯化钛中钛元素化合价为+4价,钛元素的化合价不变,B错误;
C、反应③中反应物是一种单质和一种化合物,生成物是一种单质和另一种化合物,属于置换反应;故C错误;
D、反应②Cl2中的“Cl原子”得到电子成为氯离子,D正确;
故选AD
【点评】本题考查氧化反应、化合价、反应类型及原子与离子的关系,考查知识点全面,题目较难.
已知复分解反应2CH3COOH+Na2CO3═2CH3COONa+H2O+CO2↑可进行.在常温下,测得相同浓度的下列六种溶液的pH:表中数据揭示出复分解反应的一条规律,即碱性较强的物质发生类似反应可以生成碱性弱的物质.依照该规律,请你判断下列反应不能成立的是( )
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 8.6 | 11.6 | 10.3 | 11.1 |
A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO=═NaHCO3+HClO
C.CH3COOH+NaCN═CH3COONa+HCN
D.NaClO+CH3COOH═HClO+CH3COONa
【考点】复分解反应及其发生的条件.
【专题】化学反应的基本类型和能量变化.
【分析】根据溶液的pH大于7显碱性,且pH越大碱性越强进行解答.
【解答】解:A、由表可知NaClO溶液的pH=10.3<Na2CO3溶液的pH=11.6,所以CO2+H2O+2NaClO=Na2CO3+2HClO不能成立,故A错误;
B、由表可知NaClO溶液的pH=10.3>NaHCO3溶液的pH=8.6,所以CO2+H2O+NaClO=NaHCO3+HClO能成立,故B正确;
C、由表可知NaCN溶液的pH=11.1>CH3COONa溶液的pH=8.8,所以CH3COOH+NaCN=CH3COONa+HCN能成立,故C正确;
D、由表可知NaClO溶液的pH=10.3>CH3COONa溶液的pH=8.8,所以NaClO+CH3COOH=HClO+CH3COONa能成立,故D正确.
故选:A.
【点评】此题是对复分解反应的考查,解题的重点是了解溶液酸碱性与pH的关系,属基础性知识考查题.
实验室需要把烧杯A中的氢氧化钠溶液转移到烧杯B中,将烧杯A内的液体倒入烧杯B后,烧杯A内仍残留1ml液体,之后用19mL蒸馏水清洗烧杯A的内壁,这部分液体也倾倒至烧杯B,烧杯A内残留1mL液体…需要几次这样的清洗,才能保证原烧杯中的氢氧化钠溶液99.9%都被转移至新烧杯:( )
A.2次 B.3次 C.4次 D.5次
【考点】溶质的质量分数.
【专题】溶液的组成及溶质质量分数的计算.
【分析】根据质量分数的计算公式进行分析,先算出第1次清洗倾倒后残留NaOH质量,再算出第2次清洗倾倒后残留NaOH质量,再算出第3次清洗倾倒后残留NaOH质量,然后和0.1%进行比较即可.
【解答】解:假设液体密度为1g/ml
第1次清洗倾倒后残留NaOH质量:1g×![]()
![]() =0.05g=5%
=0.05g=5%
第2次清洗倾倒后残留NaOH质量:1g×![]()
![]() =0.0025g=0.25%
=0.0025g=0.25%
第3次清洗倾倒后残留NaOH质量:1g×![]()
![]() =0.000125g=0.0125%
=0.000125g=0.0125%
而1﹣99.9%=0.1%.
故选B.
【点评】本题是关于质量分数的计算,对中学生来说,难度太大.
在Na2SO4、NaCl、NaNO3的混合溶液中,含有Na+、SO42﹣、Cl﹣、NO3﹣,已知其中Na+、SO42﹣、NO3﹣的个数比为8:1:2,则溶液中Na2SO4、NaCl、NaNO3的“分子”个数比为( )
A.1:1:1 B.1:4:2 C.1:2:4 D.1:3:2
【考点】分子、原子、离子、元素与物质之间的关系.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据溶液中的阳离子带电的电荷量与阴离子所带电电荷量相等来计算.
【解答】解:在Na2SO4、NaCl、NaNO3的混合溶液中,其中Na+、SO42﹣、NO3﹣的个数比为8:1:2,
设,溶液中Na+、SO42﹣、NO3﹣的个数分别为8n,n,2n,根据溶液中的阳离子带电的电荷量与阴离子所带电电荷量相等,故,Cl﹣个数=8n﹣2n﹣2n=4n个,
由此可知Na2SO4、NaCl、NaNO3的“分子”个数比=n:4n:2n=1:4:2;
答案:B.
【点评】本题考察强电解质的判断以及电荷守恒及其计算,综合性较强,有一定的难度.
本卷还有12题,登录并加入会员即可免费使用哦~

该作品由: 用户lanseliehu分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。