安庆高新技术开发区是国家级重点化工基地,园区的泰发新能源科技公司以煤为原料进行如图所示的流程处理,使煤变为清洁能源并生产出其他化工产品。

(1)第②步是精煤与水蒸气的反应,其反应类型是________。
(2)第②步生成的产物除了直接作气体燃料和制取甲醇外,还可以利用它们的________性来冶炼金属,写出其中一种气体与氧化铁发生反应的化学方程式________________________。
(3)甲醇与乙醇一样具有可燃性,是一种理想的清洁能源,写出甲醇充分燃烧的化学方程式__________________________________。
(4)直接燃煤与煤的深加工综合利用你认为的优点是________________________(答一点即可)。
(1)置换反应 (2)还原 3CO+Fe2O3  2Fe+3CO2(写氢气与氧化铁反应也可) (3)2CH3OH+3O2
2Fe+3CO2(写氢气与氧化铁反应也可) (3)2CH3OH+3O2  2CO2+4H2O (4)减小污染(合理即可)
2CO2+4H2O (4)减小污染(合理即可)
水垢的主要成分是CaCO3、Mg(OH)2,从水垢中制备氯化钙的主要流程如图:

(1)滤渣的主要成分是______________(填化学式),在物质分类中,该物质属于________。
(2)第③步之后加入盐酸的目的是________________________,写出该反应的化学方程式________________________________。
(3)检验软、硬水要用到____________;生活中硬水软化常用的方法是________________。
(1)Mg(OH)2 碱 (2)将过量的Ca(OH)2转化为CaCl2
Ca(OH)2+2HCl === CaCl2+2H2O (3)肥皂水 煮沸
【解析】根据从水垢中制备氯化钙的主要流程可知,先向水垢中加入稀盐酸,目的是为了将水垢中碳酸钙和氢氧化镁转化为可溶性的氯化钙和氯化镁,再加入过量的氢氧化钙溶液,将氯化镁转化为氢氧化镁沉淀以滤渣形式除去,最后向滤液中滴加稀盐酸,目的是把过量的氢氧化钙转化为氯化钙,最后蒸发结晶获得氯化钙。检验硬水和软水通常使用肥皂水,通过产生泡沫和浮渣的多少来区分,生活中采用煮沸的方法将硬水软化。
某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工艺流程如下:
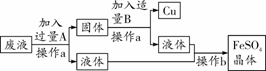
(1)操作a的名称是________。
(2)在操作b中需用玻璃棒不断搅拌,其作用是
________________________________________________________________________。
(3)写出流程中固体的成分________(写化学式),写出加入过量A时反应的化学方程式____________________________,写出加入适量B时反应的化学方程式____________________________。
(1)过滤 (2)防止局部过热,液滴飞溅(使溶液受热均匀) (3)Cu、Fe Fe+CuSO4=== FeSO4+Cu Fe+H2SO4=== FeSO4+H2↑
【解析】(1)经过操作a能得到固体和液体,故操作a为过滤。(2)从液体中得到晶体,操作b是蒸发操作,用玻璃棒不断搅拌以防局部过热液滴飞溅。(3)经过操作a得到的液体中有硫酸亚铁,说明回收铜时加入的是铁,而多余的铁(操作A后所得的固体中含有)则可与硫酸反应生成硫酸亚铁并进入液体中,最终经操作b得到硫酸亚铁的晶体,故反应化学方程式为Fe+CuSO4=== FeSO4+Cu、Fe+H2SO4=== FeSO4+H2↑。
近几年世界范围内地壳活动频繁,多地出现了高级别的地震。震灾过后,饮用水消毒是抑制传染病爆发的有效方法。漂白粉是常用的消毒剂,主要成分是次氯酸钙[Ca(ClO)2]和氯化钙,易溶于水。如图为制取漂白粉的工业流程简图:

(1)写出步骤Ⅱ中涉及的化学反应方程式__________________________。
(2)步骤Ⅲ中操作A是________。其中玻璃棒的主要作用是__________。
(3)饱和食盐水电解时发生如下反应:2NaCl + 2H2O ![]() 2X+H2↑+Cl2↑,请写出X的化学式____________,写出食盐的另一个用途____________________________。
2X+H2↑+Cl2↑,请写出X的化学式____________,写出食盐的另一个用途____________________________。
(4)通过步骤Ⅴ可以知道漂白粉具有的化学性质是______________。
(1)CaCO3  CaO + CO2↑ (2)过滤 引流 (3)NaOH 腌制食品或用作调味品或用于配制生理盐水等 (4)受热易分解
CaO + CO2↑ (2)过滤 引流 (3)NaOH 腌制食品或用作调味品或用于配制生理盐水等 (4)受热易分解
【解析】(1)石灰石的主要成分是碳酸钙,碳酸钙在高温下会分解生成氧化钙和二氧化碳。(2)步骤Ⅲ中操作A得到滤液和滤渣,所以操作A是过滤,在过滤操作中玻璃棒的作用是引流。(3)根据化学反应前后原子的种类和数目不变,可通过列表分析得出X的化学式:
| Na | Cl | H | O | |
| 反应物中原子数目 | 2 | 2 | 4 | 2 |
| 已知生成物中原子数目 | 0 | 2 | 2 | 0 |
| 差值(2X中原子数目) | 2 | 0 | 2 | 2 |
| 一个X微粒中原子数目 |
| 0 |
|
|
| X的化学式 | NaOH | |||
食盐在生活中常用于调味,腌制食品,用于融雪,医药上用于配制生理盐水等;(4)漂白粉溶液经低温蒸干得漂白粉,根据低温可知,漂白粉受热不稳定,易分解。
某实验小组利用废硫酸液制备K2SO4,设计的流程如图所示:
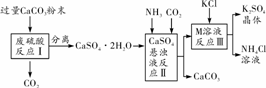
(1)反应Ⅰ中加入粉末状CaCO3的原因______________________。
(2)图中反应Ⅱ、Ⅲ后的操作名称是________;其中玻璃棒的用途是________________。
(3)反应Ⅲ中相关物质的溶解度如下表所示:
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
则反应Ⅲ的化学方程式为__________________________________________;常温下该反应能发生的原因是________________________________________________________。
(4)写出K2SO4在农业上的一点用途____________________________。
(1)增大碳酸钙与硫酸的接触面积,使反应更快更充分
(2)过滤 引流 (3)2KCl+(NH4)2SO4=== K2SO4↓+2NH4Cl 由于相同的温度下硫酸钾的溶解度较氯化钾和硫酸铵的都小,所以氯化钾和硫酸铵在溶液中相互交换离子生成硫酸钾沉淀,使溶液中钾离子和硫酸根离子的浓度都显著减少,符合复分解反应的条件 (4)用作钾肥
本卷还有12题,登录并加入会员即可免费使用哦~

该作品由: 用户mary5394分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。