如图是某同学设计的实验室制取二氧化碳并验证其性质的实验装置图.
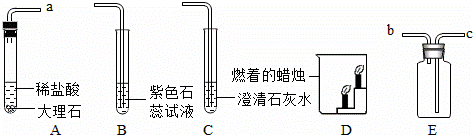
请回答下列问题:
(1)将A、E装置连接时,应将A装置的导管a与E装置的导管 (选填“b”或“c”)相连接.检验E装置中二氧化碳已收集满的方法是 .
(2)将A、B装置连接,观察到的现象是 ,可验证二氧化碳的性质是 .
(3)将A、C装置连接,可验证二氧化碳与氢氧化钙反应,该反应的化学方程式为: .
(4)用E装置收集一瓶二氧化碳气体,取下双孔橡皮塞,将瓶中的气体沿D装置烧杯左侧内壁缓慢倒入,观察到的现象时 ,这些现象说明二氧化碳具有的物理性质 ,化学性质 , .
【答案】(1) c 用燃着的木条靠近E瓶b导管口,木条火焰熄灭 .
(2)溶液由紫色变为红色 二氧化碳能与水反应生成碳酸 .
(3)Ca(OH)2+![]() CO2═CaCO3↓+H2O .
CO2═CaCO3↓+H2O .
(4)燃着的蜡烛由下至上依次熄灭 密度比空气大 不能燃烧 ,不支持燃烧 .
【解析】
试题分析:(1)将A、E装置连接时,应将A装置的导管a与E装置的导管c相连,因为二氧化碳的密度比空气的密度大,二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;故答案为:c;用燃着的木条靠近E瓶b导管口,木条火焰熄灭
(2)将A、B装置连接,观察到的现象是溶液由紫色变为红色,因为二氧化碳能与水反应生成碳酸,碳酸能使紫色变红色,故答案为:溶液由紫色变为红色;二氧化碳能与水反应生成碳酸;
(3)二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,可以用于检验二氧化碳气体的存在,故答案为:Ca(OH)2+CO2═CaCO3↓+H2O
(4)将瓶中的气体沿D装置烧杯左侧内壁缓慢倒入,观察到的现象是:燃着的蜡烛由下至上依次熄灭,这些现象说明二氧化碳具有的性质是:二氧化碳的密度比空气大;不能燃烧,不支持燃烧,故答案为:燃着的蜡烛由下至上依次熄灭;密度比空气大;不能燃烧;不支持燃烧;
化学实验是学习化学的重要方法.请完成下列金属性质的实验
(1)实验一:比较铁、铜的金属活动性强弱,请你设计实验完成下表内容。
| 实验步骤 | 实验现象 | 结 论 |
| 金属活动性:Fe>Cu |
(2)实验二:镁、锌、铁三种金属与酸的反应。
[实验]取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分反应,观察现象。
[结论]活泼金属能与酸反应。
[分析]①三个反应的共同特点是 ,写出其中一个反应的化学方程式 。
②若完全反应后,三个反应生成氢气的质量相等,原因是 。
【答案】(1)
| 实验步骤 | 实验现象 | 结 论 |
| 向硫酸铜溶液中投入铁钉 | 铁钉表面有红色固体析出,溶液由蓝色变为浅绿色 | 金属活动性:Fe>Cu |
(2)①都是置换反应;Mg+H2SO4=MgSO4+H2↑或Zn+H2SO4=ZnSO4+H2↑或Fe+H2SO4=FeSO4+H2↑;
②当三种金属过量,硫酸完全反应时,则生成氢气质量相等;当硫酸过量,三种金属完全反应,且质量比为mMg:mZn:mFe=24:65:56时,则生成氢气质量相等
【解析】
试题分析:(1)实验一,铁的活动性比铜强,能置换出硫酸铜中的铜,因此设计实验如下:
| 实验步骤 | 实验现象 | 结 论 |
| 向硫酸铜溶液中投入铁钉 | 铁钉表面有红色固体析出,溶液由蓝色变为浅绿色 | 金属活动性:Fe>Cu |
(2)①镁、锌、铁分别于硫酸反应的方程式为:Mg+H2SO4=MgSO4+H2↑或Zn+H2SO4=ZnSO4+H2↑或Fe+H2SO4=FeSO4+H2↑;反应都是一种单质和一种化合物反应产生新的单质和新的化合物,属于置换反应;
②若完全反应后,三个反应生成氢气的质量相等,可能原因是:当三种金属过量,硫酸完全反应时,根据化学方程式可知等质量的硫酸产生等质量的氢气,则生成氢气质量相等;当硫酸过量,三种金属完全反应,且质量比为mMg:mZn:mFe=24:65:56时,则![]() 生成氢气质量相等。
生成氢气质量相等。
化学实验是学习化学的重要方法.请完成下列金属性质的实验
(1)实验一:比较铁、铜的金属活动性强弱,请你设计实验完成下表内容。
| 实验步骤 | 实验现象 | 结 论 |
| 金属活动性:Fe>Cu |
(2)实验二:镁、锌、铁三种金属与酸的反应。
[实验]取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分反应,观察现象。
[结论]活泼金属能与酸反应。
[分析]①三个反应的共同特点是 ,写出其中一个反应的化学方程式 。
②若完全反应后,三个反应生成氢气的质量相等,原因是 。
【答案】(1)
| 实验步骤 | 实验现象 | 结 论 |
| 向硫酸铜溶液中 | 铁钉表面有红色 | 金属活动性:Fe>Cu |
(2)①都是置换反应;Mg+H2SO4=MgSO4+H2↑或Zn+H2SO4=ZnSO4+H2↑或Fe+H2SO4=FeSO4+H2↑;
②当三种金属过量,硫酸完全反应时,则生成氢气质量相等;当硫酸过量,三种金属完全反应,且质量比为mMg:mZn:mFe=24:65:56时,则生成氢气质量相等
【解析】
试题分析:(1)实验一,![]() 铁的活动性比铜强,能置换出硫酸铜中的铜,因此设计实验如下:
铁的活动性比铜强,能置换出硫酸铜中的铜,因此设计实验如下:
| 实验步骤 | 实验现象 | 结 论 |
| 向硫酸铜溶液中投入铁钉 | 铁钉表面有红色固体析出,溶液由蓝色变为浅绿色 | 金属活动性:Fe>Cu |
(2)①镁、锌、铁分别于硫酸反应的方程式为:Mg+H2SO4=MgSO![]() 4+H2↑或Zn+H2SO4=ZnSO4+H2↑或Fe+H2SO4=FeSO4+H2↑;反应都是一种单质和一种化合物反应产生新的单质和新的化合物,属于置换反应;
4+H2↑或Zn+H2SO4=ZnSO4+H2↑或Fe+H2SO4=FeSO4+H2↑;反应都是一种单质和一种化合物反应产生新的单质和新的化合物,属于置换反应;
②若完全反应后,三个反应生成氢气的质量相等,可能原因是:当三种金属过量,硫酸完全反应时,根据化学方程式可知等质量的硫酸产生等质量的氢气,则生成氢气质量相等;当硫酸过量,三种金属完全反应,且质量比为mMg:mZn:mFe=24:65:56时,则生成氢气质量相等。
考点:考查金属活动性顺序及其应用
科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环。
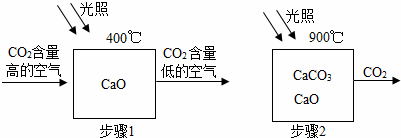
(1)步骤1的化学方程式为 。
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量
溶液,若观察到试管内 ,则分解不完全。
(3)上述设想的优点有 (填字母序号)。
a.原料易得且可循环利用
b.充分利用太阳能
c.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2的分子个数比为 ,若要检验1%甲酸水溶液是否显酸性,能选用的有 (填字母序号)。
a.无色酚酞溶液
b.紫色石蕊溶液
c.pH试纸
(5)请列举CO2的另两种用途 , 。
【答案】(1)CaO+CO2CaCO3;(2)盐酸;有气泡产生;
(3)ab;(4)1:1;bc;(5)灭火;制碳酸饮料
【解析】
试题分析:(1)根据图示信息可知二氧化碳和氧化钙在400℃生成碳酸钙,方程式是:CaO+CO2CaCO3;
(2)因为碳酸钙遇酸产生二氧化碳,所以取少量固体于试管中,滴加过量盐酸,若观察到试管内有气泡产生,则含有未分解的碳酸钙;

考点:考查二氧化碳、碳酸钙等的性质和用途
为了激发学生学习科学的兴趣,老师在课堂上为大家做了一个“燃纸成铁”的趣味实验.将一张滤纸(组成元索为C、H、O)用FeCl3浓溶液湿润,在酒精灯上烘干后点燃,滤纸变黑、红热,最终生成黑褐色物质。老师告诉大家,黑褐色物质中含有单质铁,小阳同学对此进行了分析验证。
(l)从反应物的组成分析,因为有 元素,反应后可能生成单质铁。
(2)将黑褐色物质故![]() 人稀盐酸中.发现有连续微小气泡产生,也可初步证明该黑褐色物质中含有单质铁,请写出相关的化学方程式: 。
人稀盐酸中.发现有连续微小气泡产生,也可初步证明该黑褐色物质中含有单质铁,请写出相关的化学方程式: 。
(3)证明黑褐色物质中![]() 有单质铁有多种方法.请你列举一种简单的、不需要涉及化学反应的方法 。
有单质铁有多种方法.请你列举一种简单的、不需要涉及化学反应的方法 。
【答案】(1)铁;(2)Fe+2HCl═FeCl2+H2↑;(3)用磁铁吸引
【解析】
试题分析:(1)根据质量守恒定律:反应前后元素种类不变,由于反应物中含有铁元素,所以可能生成铁单质。
(2)该黑褐色物质中含有单质铁,铁和盐酸反应生成了氯化亚铁和氢气,其反应的化学方程式为:Fe+2HCl═FeCl2+H2↑。
(3)铁粉可以被磁铁吸引,可用磁铁来吸引该黑褐色固体,若磁铁上有残留的粉末,则说明该粉末中含有铁单质。
考点:考查金属的化学性质;常见金属的特性及其应用;质量守恒定律及其应用
本卷还有5题,登录并加入会员即可免费使用哦~

该作品由: 用户徐晶分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。