《开宝本草》载: “ 硝石 ( ) 所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成 ” 。下列叙述正确的是
A .温度降低,硝石的溶解度增大 B .硝石易溶于水,且水溶液显碱性
C .产生 “ 霜 ” 的过程涉及化学变化 D .上述提纯过程涉及溶解、蒸发、结晶
D
【详解】 A .硝酸钾的溶解度随着温度的降低而减小, A 错误;
B . KNO 3 易溶于水,其水溶液为中性, B 错误;
C .产生霜的过程涉及到物理变化,无化学变化, C 错误;
D .上述提纯过程中以水淋汁涉及溶解、煎炼而成涉及蒸发、结晶, D 正确;
故答案选 D 。
下列关于物质的量浓度表述正确的是
A . 0.3 mol/L 的 Na 2 SO 4 溶液中含有 Na + 和 的总物质的量为 0.9 mol
B . 50 mL1 mol/L 的 KCl 溶液和 100 mL0.25 mol/LMgCl 2 溶液中, Cl - 物质的量浓度相等
C .将 10 mL1 mol/L 的 H 2 SO 4 加水稀释至稀释至 100 mL ,溶液的物质的量浓度变为 0.1 mol/L
D . 20℃ 时, 0.023 mol/L 的氢氧化钙饱和溶液中加入 5 g 生石灰,恢复至 20℃ ,溶液的物质的量浓度将变大
C
【详解】 A .只有溶液浓度,缺少溶液体积,不能计算微粒数目, A 错误;
B . 50 mL1 mol/L 的 KCl 溶液中 Cl - 的浓度 c (Cl - )=1 mol/L ; 100 mL0.25 mol/LMgCl 2 溶液中, Cl - 物质的量浓度 c (Cl - )=0.25 mol/L×2=0.5 mol/L ,可见两种溶液中, Cl - 物质的量浓度不相等, B 错误;
C .溶液在稀释前后溶质的物质的量不变,则根据稀释公式,可得稀释后溶液的物质的量浓度 c = , C 正确;
D .在同一温度下,同一物质的溶解度不变,则其形成的饱和溶液浓度不变,则 20℃ 时, 0.023 mol/L 的氢氧化钙饱和溶液中加入 5 g 生石灰,再恢复至 20℃ ,溶液的物质的量浓度将不变, D 错误;
故合理选项是 C 。
下图为两种固体物质 ( 不含结晶水 ) 的溶解度曲线,下列说法正确的是
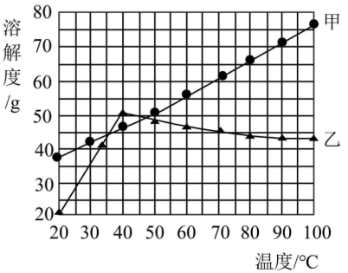
A . 恒温蒸发甲、乙两物质的饱和溶液,析出的乙比甲多
B . 向
质量分数
的甲溶液中加入
甲,溶液刚好饱和
C . ,等质量的甲、乙溶液中,溶质的质量分数相等
D . 时,乙中含有少量甲,可用蒸发溶剂的方法提纯乙
B
【详解】 A .甲、乙两物质的饱和溶液的质量未确定,不能判断析出甲和乙的多少,故 A 错误;
B .由溶解度出线可知, 时甲的溶解度为
,即
水中最多溶解
甲物质,那么
水中最多溶解
甲物质,
的甲溶液中溶质的质量为
,溶剂的质量为
,则
时,向
的甲溶液中加入
甲,溶液刚好饱和,故 B 正确;
C .由溶解度曲线可知, 时甲、乙的溶解度相等,则
时等质量的甲、乙饱和溶液中,溶质的质量分数相等,故 C 错误;
D .由溶解度曲线可知, 时甲、乙的溶解度都随温度的升高而增大,且乙受温度的影响变化较大,则
时乙中含有少量甲,可用降温结晶的方法提纯乙,故 D 错误;
故选 B 。
t ℃ 时, A 的溶解度是 S g ,其饱和溶液密度为 d g·cm -3 ,物质的量浓度为 c mol·L -1 ,溶液的质量分数为 w , A 的摩尔质量为 M g·mol -1 。实验测得向一定量含 A 的溶液中加入 m g 无水 A 或蒸发掉 n g 水后恢复到 t ℃ ,均为饱和溶液,下列关系式不正确的是
A . S= B . c=
C . S=
D . w=
×100%
C
【分析】向一定量含 A 的溶液中加入 mg 无水 A 或蒸发掉 ng 水后恢复到 t°C ,均为饱和溶液,则 t°C 时 A 的溶解度为 ;该饱和溶液的质量分数为
;再结合
、
计算。
【详解】 A . 由分析知, S = ,故 A 正确;
B . 已知 、
,则
,故 B 正确;
C . 由分析知, S= ,故 C 错误;
D .由分析知, w = ×100% ,故 D 正确;
故选 C 。
如图是 A 、 B 、 C 三种物质的溶解度曲线,下列分析正确的是
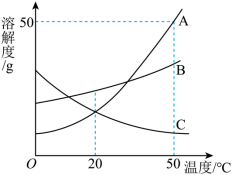
A . A 的溶解度比 B 大
B . 时把 50gA 放入 100g 水中能得到 A 的饱和溶液,其中溶质与溶液的质量比为
C .将 A 的饱和溶液变为不饱和溶液,可采用降温的方法
D .将 时 A 、 B 、 C 三种物质的饱和溶液降温至
时,这三种溶液的溶质质量分数的人小关系是
D
【分析】由图可知, A 、 B 两种固体物质的溶解度都是随温度升高而增大,而 c 的溶解度随温度的升高而减少。
【详解】 A .由图可知, 50℃ 时, A 的溶解度比 B 大, 20℃ 时, B 的溶解度比 A 大,则未注明温度,无法比较 A 和 B 的溶解度,故 A 错误;
B .由图可知, 50℃ 时, A 的溶解度是 50g ,则将 50ga 物质放入 50g 水中充分溶解得到溶液的质量为 25g+50g=75g ,则溶质与溶液的质量比为 2∶3 ,故 B 错误;
C .由图可知, A 的溶解度随温度升高而增大,则将 A 的饱和溶液变为不饱和溶液,可采用升温的方法,故 C 错误;
D . 50℃ 时 A 、 B 、 C 三种物质溶解度由大到小是 A > B > C ,所以其饱和溶液的溶质质量分数由大到小的顺序为 A > B > C ,温度降温到 20℃ 时, A 、 B 仍为饱和溶液,且 B 的溶解度大于 A 的溶解度,都大于 C 物质 50℃ 时的溶解度,所以这三种溶液的溶质质量分数的大小关系是 B > A > C ,故 D 正确;
故选 D 。
本卷还有30题,登录并加入会员即可免费使用哦~

该作品由: 用户范丽萍分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。