在 20 ℃ 时,将 40 g 氯化钠固体加入 100 g 水中,充分搅拌后,有 4 g 固体未溶解。下列说法正确的是
A . 20 ℃ 时,氯化钠的溶解度为 36 g B .该溶液不能继续溶解硝酸钾固体
C .所得氯化钠溶液的质量为 140 g D .将该溶液倒出一半,则溶液的浓度改变
A
【详解】 A. 在 20 ℃ 时,将 40 g 氯化钠固体加入 100 g 水中,充分搅拌后,有 4 g 固体未溶解,说明该温度下 100g 水中最多只能溶解 40g-4g=36g 氯化钠,则 20 ℃ 时,氯化钠的溶解度为 36 g ,该选项说法正确;
B. 该溶液是氯化钠的饱和溶液,只是不能继续溶解氯化钠,还可以溶解其他物质,该选项说法不正确;
C. 未溶解的固体不属于溶液的质量,则所得氯化钠溶液的质量为 100g+36g=136g ,该选项说法不正确;
D. 溶液具有均一性,倒出一半后,溶液的浓度不变,该选项说法不正确,
故选 A 。
如图所示是甲、乙、丙三种物质 ( 均不含结晶水 ) 的溶解度曲线,请据图判断下列说法中错误的是
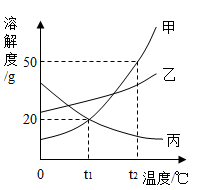
A .要从甲物质饱和溶液中获取晶体甲,可采用降温结晶的方法
B . t 2 ℃ 时,将 30g 甲物质加入到 50g 水中充分溶解后可以形成 80 克溶液
C .要配制相同质量分数的甲、丙两种物质的饱和溶液,应将温度控制 t 1 ℃
D . t 1 ℃ 时,甲、乙、丙三种物质的溶解度大小关系为:乙 > 甲 = 丙
B
【详解】 A 、如图所示,甲的溶解度受温度影响大,因此要从甲物质饱和溶液中获取晶体甲,可采用降温结晶的方法,选项正确;
B 、 t 2 ℃ 时,甲的溶解度是 30g ,说明该温度下 100g 水中最多溶解饱和 30g 甲,则将 30g 甲物质加入到 50g 水中充分溶解后会有 15g 甲未溶解,可以形成 65g 溶液,选项错误;
C 、要配制相同质量分数的甲、丙两种物质的饱和溶液,说明此时两物质的溶解度相等,根据图像 t 1 ℃ 时甲和丙的溶解度曲线交于一点,此时溶解度相等,故应将温度控制 t 1 ℃ ,选项正确;
D 、 t 1 ℃ 时,甲、乙、丙三种物质的溶解度点,乙在最上面,甲和丙重合,则大小关系为:乙 > 甲 = 丙,选项正确;
故选: B 。
以下溶解度曲线表示的含义说法错误的是
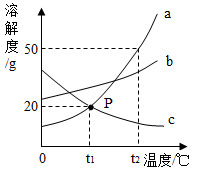
A . t 1 ℃ , a 、 c 两种物质的溶解度相等,均为 20g
B . t 2 ℃ ,三种物质的饱和溶液的质量分数的大小关系为 a > b > c
C .将 t 2 ℃ 时 b 的饱和溶液降温至 t 1 ℃ ,有晶体析出
D . t 2 ℃ ,将 30 克 a 物质加入 50 克水中,可形成 80 克溶液
D
【详解】 A 、根据溶解度曲线可知 t 1 ℃ , a 、 c 两种物质的溶解度相等,均为 20g ,故选项正确;
B 、根据溶解度曲线可知 t 2 ℃ ,三种物质溶解度大小 a > b > c ,所以此时三种物质的饱和溶液的质量分数的大小关系为 a > b > c ,故选项正确;
C 、 b 的溶解度随温度升高而增大,降低温度,该物质的饱和溶液将会有晶体析出,故选项正确;
D 、 t 2 ℃ 时,物质 a 的溶解度是 50g ,此时 50g 水中最多溶解 25g 物质 a ,可形成 50g+25g=75g 饱和溶液,故选项错误。
故选 D
在做溶解、过滤和蒸发实验时均用到的一种仪器是
A .烧杯 B .玻璃棒 C .蒸发皿 D .酒精灯
B
【详解】在做溶解、过滤和蒸发实验时均用到的一种仪器是玻璃棒,溶解时,玻璃棒的作用是搅拌、加速溶解;过滤时,玻璃棒的作用是引流,蒸发时,玻璃棒的作用是搅拌,防止局部温度过高,造成液滴飞溅。
故选 B 。
向一饱和的硝酸钠溶液中,逐渐加入硝酸钾晶体,下列图像中符合溶液中溶质质量变化
A . 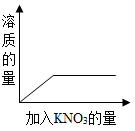 B .
B . 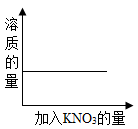
C . 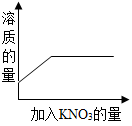 D .
D . 
C
【详解】向饱和的硝酸钠溶液中,逐渐加入硝酸钾晶体,硝酸钾能继续溶解,但硝酸钾达到饱和状态后,硝酸钾不能继续溶解,故溶质的质量先逐渐增加,后不变;由于原饱和溶液中含有溶质,故纵坐标不能从 0 开始,观察图像, C 符合变化过程。故选 C 。
本卷还有30题,登录并加入会员即可免费使用哦~

该作品由: 用户半醉分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。