质量相等的两份氯酸钾 a 和 b ,向 b 中加入少量的二氧化锰, a 中不再加入物质,然后将它们同时加热,放出氧气的质量与反应时问关系的图象正确的是
A . 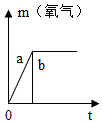 B .
B . 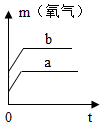
C . 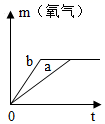 D .
D . 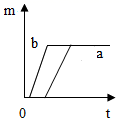
D
【详解】
A 、 b 加二氧化锰,但 a 没有加,这一反应中催化剂加快了反应的速度,但从图示可知, b 生成氧气不需时间,图象不正确,故 A 不正确;
B 、不加热不会产生氧气,曲线的起点应从 0 开始,催化剂只是加快了反应的速度并不改变生成物的量,故 B 不正确;
C 、 b 加二氧化锰, b 先产生氧气,这一反应中催化剂只是加快了反应的速度, a 与 b 产生氧气的量相同,但不会一开始就产生氧气,故 C 不正确;
D 、 b 加二氧化锰,产生氧气的速度快,但两份氯酸钾的质量相等,所以生产的氧气质量相等,但加热一段时间后才会有氧气放出,故 D 正确。
【点睛】
催化剂能只能加快化学反应速率,根据氯酸钾制取氧气的特点;不加催化剂时产生氧气的速率慢,加入催化剂后速率加快。
下列对实验现象的描述或实验操作正确的是
A . 红磷在空气中燃烧产生大量白雾
B . 镁带在空气中燃烧发出耀眼的白光
C . 做铁丝与氧气反应的实验时,火柴刚点燃就立即伸入集气瓶中
D . 加热高锰酸钾制取 O 2 可采用排水法收集气体,实验结束后,应先熄灭酒精灯,再从水中取出导气管
B
【详解】
A 、红磷在空气中燃烧产生大量白烟,不是白雾,说法错误,不符合题意;
B 、镁条在空气中燃烧发出耀眼的白光,说法正确,符合题意;
C 、做铁丝与氧气反应的实验时,火柴快燃尽伸入盛满氧气的集气瓶中,火柴刚点燃就立即伸入集气瓶中,火柴燃烧消耗集气瓶中氧气使氧气的浓度降低,导致实验失败,说法错误,不符合题意;
D 、加热高锰酸钾制取 O 2 可采用排水法收集气体,实验结束后,应先从水中取出导气管,再熄灭酒精灯,防止水槽中的水倒吸入试管,使试管破裂,说法错误,不符合题意;
答案 B 。
实验室用高锰酸钾制氧气的装置中,有关几个 “口”的位置错误的是
A . 装高锰酸钾的试管口应略向下倾斜
B . 进入试管的导气管口应露出橡胶塞少许
C . 用排空气法收集氧气时,集气瓶瓶口应向下
D . 用排水法收集氧气时,导气管口应伸入集气瓶少许
C
【详解】
A 、实验室制取气体时,加热固体时,试管口要稍微向下倾斜,因为防止生成的水或固体中所含的水分回流入试管,使试管炸裂,故 A 正确;
B 、为了便于气体的导出,试管内的导管口稍露出橡皮塞,故 B 正确;
C 、因氧气比空气的密度大,所以应用向上排气法收集,瓶口向上,故 C 错误;
D 、用排水法收集时,导气管口应伸入集气瓶口少许,便于排出集气瓶内的水进行集气,故 D 正确。
故选 C 。
同学用加热氯酸钾制取氧气时,误把高锰酸钾当作二氧化锰加入试管中,待完全反应后,和只用氯酸钾制氧气相比,其结果是 ( )
A . 反应速率加快,氧气质量不变 B . 反应速率加快,氧气质量增加
C . 反应速率不变,氧气质量增加 D . 反应速率不变,氧气质量不变
B
【详解】
高锰酸钾分解生成锰酸钾、二氧化锰和氧气,生成的二氧化锰可以作氯酸钾分解的催化剂,能加快氯酸钾的分解速率,且生成氧气,能增加氧气的质量。
故选: B 。
下列化学反应中,既不属于分解反应又不属于化合反应的是
A . 铁丝燃烧
B . 氢气燃烧
C . 石蜡燃烧
D . 碳酸受热分解
C
【详解】
A 、铁丝燃烧是铁和氧气反应生成四氧化三铁,属于化合反应,错误;
B 、氢气燃烧和氧气反应生成水,属于化合反应,错误;
C 、石蜡燃烧是石蜡和氧气反应生成二氧化碳和水,既不属于分解反应又不属于化合反应,正确;
D 、碳酸受热分解生成二氧化碳和水,属于分解反应,错误。
故选 C 。
【点睛】
分解反应:由一种物质生成两种或两种以上的物质的反应;化合反应:由两种或两种以上的物质生成一种物质的反应。
本卷还有95题,登录并加入会员即可免费使用哦~

该作品由: 用户代威威分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。