根据化学知识回答:
(1)Ⅰ 、下列有关化学史知识的说法,都正确的是 ______ 。
① 门捷列夫绘制出第一张元素周期表; ② 汤姆森发现了电子; ③ 卢瑟福提出行星运转式原子结构的模型; ④ 道尔顿创立了原子论; ⑤ 拉瓦锡发现空气的主要成分; ⑥ 酸碱指示剂的发现是英国化学家波义尔敏锐观察的结果; ⑦ 我国化学家张青莲为测定相对原子质量作出突出贡献; ⑧ 我国科学家侯德榜创立了 “ 氨碱法 ” 制纯碱。
A . ①②③④⑤⑥⑦ B . ①②④⑤⑥⑦⑧ C . ①②④⑤⑥⑦ D . ①②③④⑤⑥⑦⑧
Ⅱ 、有限的元素可组成种类繁多的物质,依据表中的元素回答下列问题。
| 元素名称 | 氢 | 碳 | 氧 | 氯 | 铜 | 钠 | 铁 | 钙 |
| 元素符号 | H | C | O | Cl | Cu | Na | Fe | Ca |
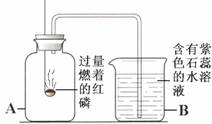
(2) 若某物质为厨房里的常见液体调味品,则它可以是 ______ (填化学式)。
(3) 若某物质是一种红色铁矿石的主要成分,则该物质是 ______ (填名称)
(4) 波尔多液为农业常用的杀菌剂,写出配制波尔多液反应方程式为 ______ 。
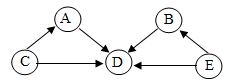
(5)A 、 B 、 C 、 D 、 E 是五种常见物质,且都由表中的元素组成。其中 A 被认为是最理想的燃料。 D 物质是一种最常用的溶剂, B 物质可用于玻璃、造纸、纺织、洗涤剂的生产等。下列说法正确的是 ______ 。 A .上述物质之间的转化可以是四种基本反应类型
B .上述五种物质不可能为五种不同类别的物质
C .盛放 B 物质的试剂瓶应用玻璃塞,因为密封更好
D . C 与 B 或 E 反应时产物可能均相同
答案
(1)A
(2)CH 3 COOH
(3)Fe 2 O 3
(4)
(5)AD
【解析】( 1 )
① 门捷列夫发现了元素周期律,绘制出第一张元素周期表,正确;
② 汤姆森发现了电子,从而证明了原子是可分的,正确;
③ 卢瑟福提出了原子结构的行星模型,正确;
④ 道尔顿创立了原子论,正确;
⑤ 拉瓦锡用定量的方法测定了空气的成分,得出空气是由氮气和氧气组成的结论,正确;
⑥ 酸碱指示剂的发现是英国化学家波义尔敏锐观察的结果,正确;
⑦ 我国化学家张青莲为测定相对原子质量作出突出贡献,正确;
⑧ 我国科学家侯德榜在氨碱法的基础上创立了更为先进的联合制碱法,错误。
故正确的是 ①②③④⑤⑥⑦ 。
故选 A ;
( 2 )
若某物质为厨房里的常见液体调味品,可以是醋酸,化学式为: CH 3 COOH ;
( 3 )
若某物质是一种红色铁矿石的主要成分,则该物质是氧化铁,化学式为: Fe 2 O 3 ;
( 4 )
配制农药波尔多液的反应为硫酸铜和氢氧化钙反应生成氢氧化铜和硫酸钙,该反应的化学方程式为: ;
( 5 )
A 、 B 、 C 、 D 、 E 是五种常见物质,且都由表中的元素组成。其中 A 被认为是最理想的燃料,可推出 A 为氢气; D 物质是一种最常用的溶剂,可推出 D 为水, C 能转化为 A 和 D ,可推出 C 为稀盐酸, B 物质可用于玻璃、造纸、纺织、洗涤剂的生产等,可推出 B 为碳酸钠, E 能转化为碳酸钠和水,可推出 E 为氢氧化钠或碳酸氢钠。
A 、 C 转化为 A 可以为铁和稀盐酸反应生成氯化亚铁和氢气,符合 “ 一种单质与一种化合物反应生成另一种单质和另一种化合物 ” 的反应,属于置换反应, C 转化为 D 可以为氧化铁和稀盐酸反应生成氯化铁和水,该反应符合 “ 两种化合物互相交换成分生成另外两种化合物 ” 的反应,属于复分解反应, A 转化为 D 为氢气和氧气在点燃的条件下反应生成水,符合 “ 多变一 ” 的特点,属于化合反应; B 转化为 D 为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,该反应符合 “ 两种化合物互相交换成分生成另外两种化合物 ” 的反应,属于复分解反应, E 转化为 B 、 D ,可以为碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,符合 “ 一变多 ” 的特点,属于分解反应,上述物质之间的转化可以是四种基本反应类型,符合题意;
B 、 A 为氢气,属于单质; B 为碳酸钠,属于盐, C 为稀盐酸,属于酸, D 为水,属于氧化物, E 可为氢氧化钠,属于碱,属于五种不同类别的物质,不符合题意;
C 、 B 为碳酸钠,碳酸钠能与二氧化硅反应生成硅酸钠,故盛放 B 物质的试剂瓶不能用玻璃塞,不符合题意;
D 、 C 与 B 反应为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水, C 与 E 反应可以为碳酸氢钠和稀盐酸反应生成氯化钠、二氧化碳和水,产物可能相同,符合题意。
故选 AD 。