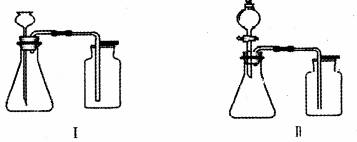(探究活动一)为探究催化剂的种类对氯酸钾分解速率的影响,甲同学设计如表对比实验:
| | 氯酸钾的质量 | 催化剂的种类 | MnO 2 的质量 | 反应条件 | 收集 45.0mLO 2 所需的时间( s ) |
| Ⅰ | 3.0g | MnO 2 | 1.0g | 混合加热 | 21 |
| Ⅱ | xg | CuO | 1.0g | 混合加热 | 48 |
( 1 )表中 x 的值应为 _____ ;通过分析上表数据,可以得出的实验结论是:在相同的条件下, KC1O 3 在 MnO 2 作催化剂比 CuO 作催化剂的分解速率 _____ (选填 “快”或“慢”)。
(探究活动二)为探究双氧水浓度对过氧化氢分解速率的影响,乙同学设计以下实验:
(进行实验)
室温下,选用 50.0g 不同溶质质量分数的双氧水( 1% 、 2% 和 4% )分别与 0.1g 二氧化锰进行实验(如图 1 ,固定夹持仪器略去)。
( 2 )写出双氧水分解的化学方程式 _____ , MnO 2 在 H 2 O 2 分解前后其质量和 _____ 没有发生改变。
( 3 )按下图装置图 1 进行实验,在装药品前应检查该装置的气密性,具体做法是关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后 _____ 则证明该装置气密性良好。
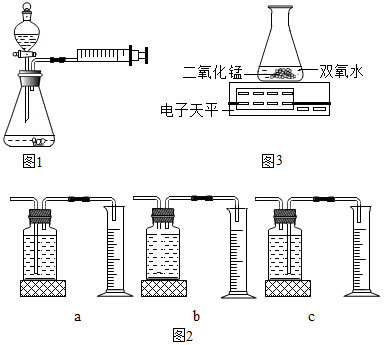
(数据处理)
( 4 )乙同学进行实验后,获得的相关实验数据记录如表所示:
| | 双氧水的质量 | 双氧水的浓度 | MnO 2 的质量 | 温度 | 相同时间( 10s )内产生 O 2 体积( mL ) |
| Ⅰ | 50.0g | 1% | 0.1g | 20 ℃ | 9 |
| Ⅱ | 50.0g | 2% | 0.1g | 20 ℃ | 16 |
| Ш | 50.0g | 4% | 0.1g | 20 ℃ | 31 |
①本实验中,测量 O 2 体积的装置也可以选用如图 2 的哪套装置来代替 _____ (填编号)。
②分析上表数据,可以得出不同浓度的双氧水对过氧化氢分解速率影响的结论是: _____ 。
( 5 )丙同学认为用图 3 装置进行实验,通过比较 _____ 也能探究双氧水浓度对过氧化氢分解速率的影响。
答案
3.0 快 化学性质 注射器活塞回到原来位置 c 在相同条件下,双氧水浓度越大,过氧化氢的分解速率越快 相同时间天平读数差值大小(其他答案合理也可)
【详解】
探究活动一:
该实验的目的是探究催化剂的种类对氯酸钾分解速率的影响,除了催化剂的种类不同,其它元素都应相同,故 x 的值应为 3.0g ;
由表中数据可知,二氧化锰作催化剂时,收集 45.0mL 氧气所需的时间较短,说明氯酸钾在二氧化锰作催化剂比氧化铜作催化剂的分解速率快;
探究活动二:
进行实验:
( 2 )过氧化氢能在二氧化锰的催化下分解为水和氧气,该反应的化学方程式为 ;
在该反应中,二氧化锰是催化剂,化学反应前后,其质量和化学性质没有发生改变;
( 3 )在装药品前应检查该装置的气密性,具体做法是关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后,注射器活塞回到原来位置,则证明该装置气密性良好;
( 4 ) ①本实验中,测量 O 2 体积的装置也可以选用如图 2 的 c 装置来代替,氧气的密度比水小,氧气应从短管进入,水从长管排出,故应选 c 装置;
②由表中数据可知,在相同条件下,双氧水的浓度越大,相同时间内产生氧气的体积越大,说明在相同条件下,双氧水浓度越大,过氧化氢的分解速率越快;
( 5 )用图 3 装置进行实验,通过比较相同时间天平读数差值大小也能得出单位时间内产生气体的量,从而探究双氧水浓度对过氧化氢分解速率的影响。

 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
 2H2O+O2↑
2H2O+O2↑