
实验课上,老师在分析复分解反应条件时指出,硫酸铜溶液可以和氢氧化钠溶液反应。小明很好奇,于是做了硫酸铜溶液和氢氧化钠溶液反应的实验。
(进行实验)在放入盛有 20 毫升硫酸铜溶液的烧杯中,滴加一定量的氢氧化钠溶液,出现了蓝色絮状沉淀,将反应后烧杯中的混合物进行过滤,得滤渣和无色滤液。
(提出问题) ①产生蓝色沉淀的原因?②无色滤液中的溶质是什么?
请你帮小明分析产生蓝色沉淀的原因 _____ (用化学方程式表示)
(实验探究一)探究无色滤液的溶质是什么?
(猜想与假设)猜想 ① Na 2 SO 4 ,猜想 ② Na 2 SO 4 、 NaOH ,猜想 ③ Na 2 SO 4 、 CuSO 4
大家一致认为猜想 ③是错误的,理由是 _____
(实验验证一)验证其余猜想,进行了下列实验
| 实验步骤 | 实验现象 | 结论 |
| 取少量无色滤液,向其中加入 _____ | _____ | 猜想②成立 |
(实验异常现象)同学们将饱和硫酸铜溶液逐滴加到 5mL 饱和氢氧化钠溶液中,观察到以下异常实验现象:
| 实验序号 | 滴加 CuSO 4 溶液的量 | 实验现象 |
| ① | 第 1 ~ 6 滴 | 有蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第 7 ~ 9 滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
(实验探究二)实验 ① 中蓝色沉淀为什么消失?同学们继续进行如下探究.
(查阅资料)氢氧化铜在温度 70 ℃﹣ 80 ℃时可分解生成黑色的氧化铜;
(猜想与讨论)小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解.其他同学一致否定了他的猜测,理由是 _____ ,同学们交流讨论后,提出以下两种猜想:
猜想一:少许氢氧化铜可溶于足量水中.
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色.
(实验验证二)同学们用氢氧化铜粉末设计如下实验.请填写表中空格.
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许 Cu(OH) 2 粉末加到 5mL 蒸馏水中,充分振荡 | _____ | 猜想一错误 |
| ④ | 将少许 Cu(OH) 2 粉末加入到 _____ | _____ | 猜想二正确 |
(结论与反思)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是 _____ .
CuSO 4 +2NaOH=Na 2 SO 4 +Cu(OH) 2 ↓ 滤液是无色,溶质不可能含硫酸铜 酚酞试液 溶液颜色变红(或硫酸铜溶液;有蓝色沉淀) 如分解则生成的氧化铜是黑色固体,而蓝色沉淀消失后是形成亮蓝色溶液 沉淀不溶解,液体仍为无色 足量氢氧化钠浓溶液中,充分振荡 固体溶解,溶液呈亮蓝色 蓝色沉淀逐渐变为黑色
【解析】
硫酸铜与氢氧化钠生成蓝色沉淀方程式为 CuSO 4 +2NaOH=Na 2 SO 4 +Cu(OH) 2 ↓
【猜想与假设】因为所得溶液是无色透明的,若溶液中溶质有硫酸铜,则溶液呈蓝色。所以猜想 ③错误。
【实验验证一】两个猜想都有硫酸钠,且硫酸钠显中性,区别在于有无氢氧化钠,因此只需验证 NaOH 的存在即可。常用验证氢氧化钠存在的试剂为酚酞溶液,若溶液变红色证明猜想 ②正确
【猜想与讨论】若氢氧化铜发生分解,则会产生不溶于水的氧化铜黑色沉淀,二无法得到亮蓝色的溶液。因此小陶的猜想错误
【实验验证二】 ③猜想一为 “ 氢氧化铜可少量溶于水 ” ,实验证明猜想一错误,说明氢氧化铜不溶于水,则实验现象应为溶液为无色,沉淀不溶解。
④的实验证明猜想二是正确的,猜想二为 “ 氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色 ” ,因此实验 ④使用的试剂是足量的氢氧化钠溶液,并为了加速溶解需要震荡,现象为固体粉末溶解,溶液呈亮蓝色
【结论与反思】因为氢氧化铜在温度 70 ℃﹣ 80 ℃时可分解生成黑色的氧化铜,而开始溶液的温度为常温,最后生成的纯度由蓝色变黑色,说明氢氧化铜发生了分解。从常温至 70 ℃﹣ 80 ℃,说明反应是放热的。
故答案为: CuSO 4 +2NaOH=Na 2 SO 4 +Cu(OH) 2 ↓ ;滤液是无色,溶质不可能含硫酸铜;酚酞试液;溶液颜色变红(或硫酸铜溶液;有蓝色沉淀);如分解则生成的氧化铜是黑色固体,而蓝色沉淀消失后是形成亮蓝色溶液;沉淀不溶解,液体仍为无色;足量氢氧化钠浓溶液中,充分振荡;固体溶解,溶液呈亮蓝色;蓝色沉淀逐渐变为黑色
【点睛】
突破口:基于对中学中一些常见物质的物理性质(颜色、状态)以及其发生化学反应后这些现象的变化,即可一步步做出这类题目
登录并加入会员可无限制查看知识点解析
小红用如图装置验证了质量守恒定律,还发现产物中有少量黄色固体。
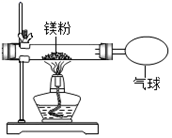
【提出问题】 黄色固体是什么?
【查阅资料】 ①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应生成氨气,该气体能使湿润的红色石蕊试纸变蓝。
【作出猜想】 黄色固体是氮化镁。
【实验探究】 设计实验,验证猜想:
| 实验操作 | 实验现象 | 实验结论 |
| 取燃烧后的产物于试管中,加入少量的_,再将_放在试管口 | ____ | 猜想成立 |
【反思与交流】 空气中氮气的含量远大于氧气的含量,可是镁条在空气中的燃烧产物氧化镁却远多于氮化镁,合理的解释是_。镁在氮气中燃烧的化学方程式为______。
【拓展延伸】 同学们再次查阅资料得知,镁还能在二氧化碳中燃烧,生成一种白色固体氧化物和一种单质,试写出该反应的化学方程式:__。
除去下列物质中的少量杂质,下列选用试剂或方法正确的是( )
| 选项 | 物质 | 杂质 | 试剂或方法 |
| A | FeSO4溶液 | CuSO4 | 加入过量的锌粉,过滤 |
| B | NaCl | Na2CO3 | 加入过量稀盐酸,蒸发 |
| C | CaCl2溶液 | HCl | 加入过量的Ca(OH)2溶液 |
| D | KCl | MnO2 | 加入足量水溶液、过滤、洗涤、烘干 |
A.A B.B C.C D.D